В литературе сохраняется условное разделение остеоартрозов на первичные и вторичные (Mohr W., 1984; Чепой В. М., 1990). Причинные факторы первичных артрозов не выяснены. Постулируется точка зрения, что в их основе лежат недиагностированные варианты дисплазии и генетические факторы (Сименач Б. И. и др., 1990). Так, доказано, что в семьях больных деформирующим артрозом это заболевание встречается в два раза чаще, чем в общей популяции (Lawrence J. S., 1971). Кроме того, установлено, что генерализованные формы остеоартрозов прослеживаются у 67% монозиготных и 33% дизиготных близнецов женского пола, однако более убедительных доказательств по этому вопросу по сей день не получено.
Оба вида остеоартрозов невозможно четко отграничить друг от друга по данным, характеризующим патологические нарушения в суставах. Причинными факторами вторичных артрозов считают деформации, резвившиеся на основе заболеваний (мукополисахаридозов, эпифизарной дисплазии, врожденной дисплазии суставов) или травмы (переломы, удаление мениска), при метаболических, иммунных и эндокринных нарушениях (акромегалия, болезнь Марфана, хондрокальциноз, охроноз, диабет и т. д.), заболеваниях крови (гемоглобинопатия и гемофилия), некрозах кости (асептический некроз), воспалительных заболеваниях (ревматические и инфекционные артриты). В добавление к этому — макро- и микротравмирование, а также иммобилизация нормального сустава могут привести к развитию в нем остеоартроза.
То есть все имеющиеся факторы могут быть сведены как минимум к двум условиям, вызывающим нарушения организации и функционирования суставного хряща: 1) изменению внутренней среды организма и 2) действию неблагоприятных внешних условий (Астапенко М. Г., 1975). Однако прямые доказательства отсутствуют и предпочтения ни одному из перечисленных выше факторов не отдают.
К факторам внутренней среды организма, представляющим наибольший интерес, относится состояние эндокринного статуса организма. Остановимся более подробно на этих данных, учитывая, что им уделяется большое внимание в иностранной литературе, а в нашей стране подобных исследований практически не имеется. В настоящее время доказано, что гормональные влияния являются существенными регуляторами на этапах роста и развития хрящей, а хондроциты имеют специфические рецепторы к ряду гормонов: тироксину (Stevens R. L. et al., 1986), инсулину (Stuart С.А. et al., 1979), глюкокортикоидам (Adolphe M., Blondelon D., Lechat P., 1980), соматотропину (Eden S. et al., 1973), эстрадиолу (Rosner I. A. et al., 1982), тестостерону (Takahashi Y. et al., 1984). В экспериментальных условиях показано, что дисбаланс гормонов в организме приводит к изменению метаболизма хрящевой ткани, в связи с чем нарушение эндокринной ситуации может рассматриваться как фактор риска остеоартрозов.
В 1940 году М. Silberberg, N. Silberberg показали, что введение животным экстракта гипофиза приводит к дистрофии суставных хрящей, а введение эстрогенов благоприятно влияет на их метаболизм.
В 1966 году S. Seze и A. Ryskewaert высказали точку зрения о том, что нарушение гипофизо-генитального равновесия, особенно в климактерическом периоде, может явиться патогенетическим звеном остеоартрозов. В более поздних работах было показано, что хрящевые ткани являются мишенями для половых гормонов. Доказано, что эстрадиол и тестостерон проникают в хрящевые клетки, в которых подвергаются метаболическим превращениям (Pewuim Т., Adams J., 1979; Takahashi Y. et al., 1984). При этом основной аспект их влияния на метаболизм хрящей — участие в ростовых процессах и созревании хрящевой ткани (Strickland A. L., Sprintz Н., 1973; Дедух Н. В., Панков Е. Я., 1988). Доказано, что эстрогены оказывают выраженное ингибирующее действие на рост и метаболизм хрящевой ткани, а их высокие концентрации вызывают эрозирование хрящей (Silberberg R. et al., 1965; Rosher J. A. et al., 1979).
Клинические и лабораторные исследования позволили предположить, что имеется некая взаимосвязь между половыми гормонами и течением остеоартрозов. Эпидемиологические исследования показали наличие связи между повышением возраста и степенью тяжести протекания остеоартрозов у женщин. Так, выявлено, что у женщин старше 50 лет остеоартрозы протекают тяжелее, чем у мужчин и при этом поражается большее количество суставов (Acheson В. N., Chen V. К., Clemett A. R., 1970; Kellgren I. Н., Lawrence I. S., Bier F., 1963). Кроме того, жалобы на боль прямо связаны с климактерическим периодом и ослабевают при применении эстрогенов (Prill Н. I., Lauritzen С., 1970). Однако терапевтическая целесообразность применения эстрогенов при остеоартрозах дискутируется (Rosner I. A., Goldberg V. М., Moskowitz R. W., 1986; Астапенко М. Г., 1975).
Данные о роли тестостерона в метаболизме хрящей противоречивы. На сбалансированном гормональном фоне единичные инъекции животным тестостерона либо не оказывали никакого воздействия на процесс сульфирования протеогликанов, либо изменяли его в малой степени (Collins Е. J., Anilane J., 1959; Salmon W. D. et al., 1963). Кастрация также не отражалась на этом процессе, однако способствовала увеличению уровня гиалуроновой кислоты в хрящах (Kofoed J.A. et al., 1970), что свидетельствует о замедлении процесса созревания хрящевой ткани. Однако на фоне снижения уровня СТГ в крови тестостерон стимулирует процесс сульфатирования аминосахаров (Collins Е. G., Anilane Т., 1959; Salmon W. D. et al., 1963). При испытании тестостерона в культуре ткани выявить изменений в метаболизме гликозаминогликанов не удалось (Salmon W. D. et al., 1963), что указывает на сложный механизм действия тестостерона на хрящевую ткань. Продолжительное введение животным больших доз тестостерона вызывало выраженные деструктивные и дистрофические нарушения в суставном хряще на ранних этапах, сопровождающиеся снижением активности ряда ферментов (Tarsoly Е., 1975). Аналогичные изменения отмечены и у гипофизэктомированных крыс, что, по мнению Е. Tarsoly (1975), свидетельствует о непосредственном действии тестостерона на хрящ. Однако степень выраженности у гипофизэктомированных крыс была выше, по-видимому, вследствие ингибирования биосинтеза ряда гормонов, вырабатываемых гипофизом, в отсутствие обратимого влияния тестостерона на гипофиз. На основе представленных выше данных и с учетом работы Н. Lebovitz, G. Eisenbarth (1975) можно сформулировать вывод о том, что старение хрящевой ткани и, возможно, остеоартрозы связаны с тестикулярным дисбалансом.
Роль тироксина в процессах роста и дифференцировки хряща доказана. Установлено, что биосинтез коллагена и протеогликанов в хрящевой ткани регулируется тироксином. Так, при гипотиреозе и особенно при гипертиреоидных состояниях организма установлено ингибирование биосинтеза и деградация макромолекул коллагена в хрящах (Kivirikko K.I., 1967). Доказано, что высокие дозы тироксина стимулировали процесс сульфирования протеогликанов, а низкие — ингибировали (Herbai G., 1971). В эксперименте на животных нами доказано, что введение тироксина 50 мкг/100 г массы молодым белым лабораторным крысам способствовало активации биосинтетических процессов в клетках за счет расширения объемной доли цитоплазматической сети, комплекса Гольджи и митохондрий. Преобразования в матриксе происходили за счет накопления кератансульфатов, что указывало на повышение созревания суставного хряща. В зрелом возрасте роль тироксина в регуляции метаболизма суставного хряща ограничена, о чем свидетельствует факт, что преобразования в хондроцитах и матриксе обнаруживались только в условиях высокой концентрации тироксина. Это воздействие сопровождалось прогрессированием дистрофии и деструкции в суставных хрящах (Дедух Н. В., 1988). Накопление метаболитов тиреоидных гормонов в синовиальной жидкости зафиксировано при воспалительных процессах в суставах (Kleesiek К., Muller К., Greiling Н., 1981), что может быть рассмотрено как фактор риска в деструкции суставного хряща.
О разбалансированности уровня тироксина и трийодтиронина в крови при ревматоидном артрите свидетельствуют данные, полученные В. А. Кельнев, Л. А. Кириченко, А. Я. Блюменталь (1987). Нами выявлено нарушение функционирования щитовидной железы у больных коксартрозами (Дедух Н. В. и соавт., 1988). Установлено, что уровень трийодтиронина находится на нижней границе нормы, тироксина — в пределах ее верхней границы, а у 30% больных коксартрозом уровень тироксина в 1,3 раза превышал норму. В целом, механизмы патогенеза остеоартрозов в условиях нарушения функционирования щитовидной железы нуждаются в дальнейшем изучении.
О характере действия инсулина на хрящевую ткань в литературе представлены противоречивые мнения: с одной стороны, постулируется точка зрения, что инсулин не принимает участия в регуляции метаболических процессов в хрящевой ткани (Salmon W. D., Duvall М. R., 1980), а с другой — хрящевую ткань можно рассматривать как мишень к его действию (Burch W. В., Kenneth V. С.,1984; Bembenek М. F., 1982). Противоречивость заключений отчасти может быть связана с используемыми объектами исследований (анаплазированная или интактная хрящевая ткань, хрящи, полученные от животных после моделирования диабета, и др.), а также условиями проведения экспериментов — в культуре ткани или на организменном уровне. Убедительным доказательством управления метаболическими процессами в хрящевой ткани инсулином является обнаружение на цитолемме хондроцитов специфических рецепторов к этому гормону (Stuart С. A. et al., 1979; Foley Т. R. et al., 1982). Кроме того, воздействие инсулина на синтез специфических макромолекул хрящевой ткани может осуществляться непосредственно через рецепторы к соматомедину A (Fsakawa К. et al., 1983).
Установлено, что инсулин в физиологических концентрациях влияет на процессы роста и дифференцировки хрящей, однако, как дефицит инсулина в организме, так и высокие концентрации могут привести к развитию в суставах дистрофических изменений (Хадхази Ч., Дедух Н. В., 1988; Дедух Н. В., 1988). В связи с тем, что инсулин широко применяется при лечении диабета, рассмотрим проблему артропатии в единстве с нарушением метаболического состояния организма при этом заболевании. Доказано, что при инсулинозависимом диабете повреждаются, в первую очередь, суставы стопы, что может быть связано как с состоянием гипергликемии, так и нарушением функционирования инсулина. При гистологическом исследовании суставов в них обнаруживаются напластования костной ткани, фибротизация или разрушение суставного хряща, разрастания в суставах грануляционной ткани. В синовиальной мембране выявляются поля фиброза и гиалиноза (Huth F., Weller-Boothe В. М., 1979), обширные очаги детрита (Frykberg R. G., Kozak G. Р., 1978). В связи с тем, что назначение больным диабетом инсулина и лечение проводится зачастую без контроля его уровня в сыворотке крови, вопросы профилактики и лечения дистрофических заболеваний суставов при этой патологии стоят особенно остро, а в плане фармакологической коррекции необходимо тестирование противодиабетических препаратов по их влиянию на метаболические процессы в суставном хряще.
При повышении в крови уровня паратгормона артропатии обнаруживаются у 63% пациентов и связаны, прежде всего, с нарушением метаболизма и структуры кости. В последующем повреждения в субхондральной кости сочетаются с нарушениями целостности суставного хряща и осложняются посттравматическими синовитами. К факторам, индуцирующим синовит, может быть отнесено и усиление образования кристаллов пирофосфата или прямое влияние паратгормона на биосинтез коллагена в капсуле и связках (Lipson R. L., Williams L. Т., 1968). Синовит сопровождается появлением очагов детрита в синовиальной мембране, а в суставном хряще зачастую обнаруживаются поля волокнистой ткани. В противоположность этим изменениям при гипопаратиреоидизме в первую очередь нарушается развитие эпифизарного хряща, а в суставах изменяется синовиальная оболочка, в основном за счет повышения объема коллагеновых волокон и ГАГ. Однако воспалительных процессов в ней при этом состоянии практически не зарегистрировано (Dorwart В. В., Schumacher Н. R., 1975).
В настоящее время на базе клиники патологии крупных суставов развернуты комплексные исследования гормонального статуса больных с коксартрозами (Кулиш Н. И. и соавт., 1988; Дедух Н. В. и соавт., 1988; Костерин С. Б. и соавт., 1991). Предварительные результаты свидетельствуют о нарушении эндокринного баланса организма у этой группы больных. Дальнейшие исследования по выяснению причинно-следственных отношений, изучению эндокринного баланса организма позволят уточнить особенности проявления, тем не менее, дезинтеграция эндокринного статуса организма может быть рассмотрена как фактор повышенного риска в возникновении патологических процессов в суставах.
Не ослабевает интерес к выяснению взаимосвязи и взаимозависимости остеоартрозов с возрастом. Общеизвестно, что с повышением возраста значительно увеличивается процент остеоартрозов. Но, в целом, связать остеоартроз с теориями старения, в том числе и с теорией, базирующейся на генетическом программировании клеток на определенную продолжительность жизни, либо с теорией, связывающей старение с накоплением случайно приобретенных повреждений (мутаций), чрезвычайно сложно. Хотя имеется точка зрения, что старение — один из факторов, вызывающих метаболические нарушения хондроцитов. Это приводит к продуцированию клетками „неполноценных” компонентов матрикса, что, в свою очередь, отражается на организации суставного хряща. Однако лишь у отдельных индивидуумов при неблагоприятных условиях эти изменения в матриксе могут привести к остеоартрозу (Hough A. J., Weber R. J., 1986).
Для каждого сустава скелета характерна определенная кинетика развития патологического процесса. Еще в 1926 году. J. Heine на основании данных эпидемиологических исследований установил, что при повышении возраста к наиболее поражаемым суставам могут быть отнесены коленный и локтевой суставы, в меньшей мере — плечевой. Промежуточное положение между ними занимают тазобедренные суставы, частота патологии в которых к 80 — 95 годам достигает 60% (рис. 2.1.).
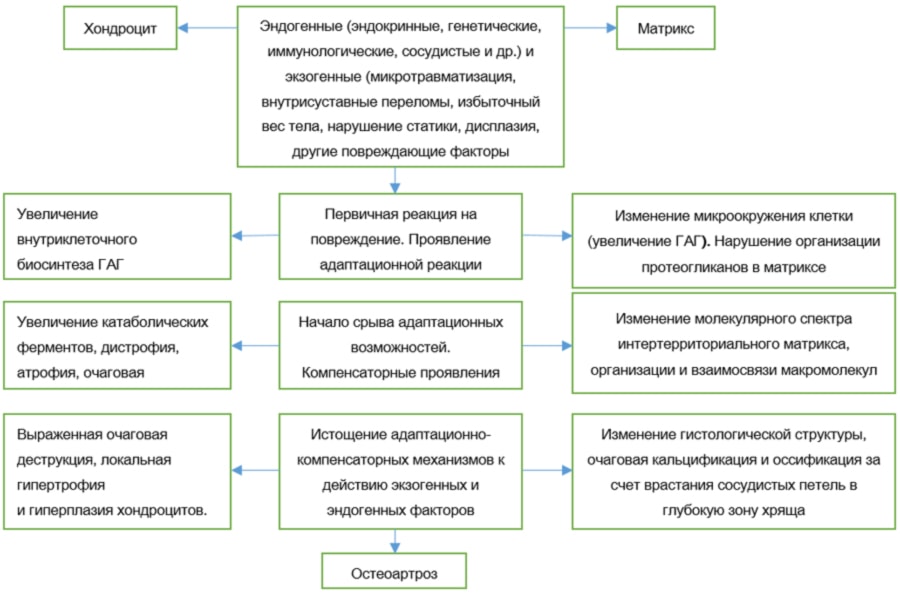
Несмотря на множество факторов, выдвигаемых в качестве этиологических, все теории патогенеза остеоартрозов сходятся на том, что имеется финальная точка патологического пути, замыкающаяся на клетках и матриксе суставного хряща (рис. 2.2.).
Нельзя не коснуться так называемой биохимической концепции, по которой нарушения биосинтеза и организации основных компонентов матрикса — протеогликанов и коллагена — могут привести к дистрофии и деструкции суставного хряща.
К ранним признакам остеоартрозов можно отнести снижение метахромазии и нарушение распределения гликозаминогликанов в суставном хряще. Однако на сегодняшний день доказано, что это снижение — не результат угасания биохимических процессов в хондроцитах. Более того, большинство исследователей указывают на повышение в клетках биосинтеза протеогликанов при остеоартрозах (Roughley Р. J., 1987; Sandy J. D. et al., 1987). Однако хрящ имеет пониженную способность удерживать вновь синтезированные хондроцитами макромолекулы в матриксе за счет превращения их в форму, неспособную вступать в связь с гиалуроновой кислотой (Roughley Р. J., 1987). Кроме того, имеются данные, что уменьшение общего уровня ГАГ в артрозных хрящах, особенно хондроитинсульфатов и кератансульфатов, может быть следствием длины цепей этих полисахаридов (Bollet A. J., Nance J. L., 1966), по всей видимости за счет аминосахаров. Кроме того, в артрозных хрящах происходит снижение биосинтеза связывающего белка „link-protein”, являющегося стержневой основой протеогликанов (Adams М. Е., Grant М. D., 1987). В артрозном суставном хряще увеличивается соотношение протеин/полисахариды и галактозамин/глюкозамин (Hardingam Т. Е., 1977; McDevitt С. A., Muir Н., Pond М. J., 1973).
Рис. 2.2. Концептуальная модель остеоартрозов, основанная на морфологических, в том числе гистохимических данных.
Имеется и другая точка зрения на механизм патогенеза остеоартрозов, обоснованная экспериментально (Sapolsky А., Malemud Ch., Sheff М., 1987). Авторы считают, что важным патогенетическим звеном, приводящим к деструкции протеогликанов хряща, является функционирование нейтральных металлозависимых протеаз — протеогликаназ, которые в норме вырабатываются хондроцитами в неактивной форме. Активация этих ферментов происходит при отщеплении молекулы массой 10000 дальтон (Sapolsky A., Malemud Ch., Sheff М., 1987). На следующем этапе заболевания в суставном хряще уменьшается количество клеток, упрощается их структурная организация, что влечет за собой снижение биосинтетических процессов и сопровождается нарушением макромолекулярной организации матрикса. Гибель клеток сопряжена с выбросом большого количества лизосомальных ферментов в синовиальную жидкость, что, в свою очередь, приводит к формированию порочного круга; нарушение состава и вязкости синовиальной жидкости -» дистрофия и деструкция хряща.
На более поздних этапах развития заболевания нарушается поверхность суставного хряща за счет разволокнения, формирования горизонтальных и вертикальных трещин (рис. 2.3). В других зонах суставного хряща обнаруживается демаскирование коллагеновых волокон, вплоть до формирования деструктивных полостей. Нарушается цитоархитектоника хряща. Толщина суставного хряща на участках резко уменьшается вплоть до его полного исчезновения. В таких случаях в полость сустава становятся обращены трабекулы субхондральной кости и открыты межтрабекулярные пространства, выполненные детритом. Вследствие неадекватной нагрузки в головке бедренной кости или в мыщелках бедренной кости в краевых отделах сустава формируются остеофиты, имеющие хрящевую или костную природу.
Наряду с процессами дистрофии и деструкции, в хряще протекают и репаративные процессы, но течение их в условиях патологии приобретает „извращенный характер” — среди значительных бесклеточных территорий в суставном хряще определяются очаги гиперплазии клеток, которые формируют изогенные группы, насчитывающие до 32-х хондродитов (рис. 2.3). Если в норме суставные хрящи не содержат сосудов, то в условиях дистрофии хрящ прорастает сосудами. По всей вероятности, это связано с блокированием функционирования антисосудистого фактора, содержащегося в некальцифицирующейся части суставного хряща. Этот фактор может быть экстрагирован из хрящей гуанидиум гидрохлоридом (Lander R. et al., 1976) и именно его присутствие в хрящах (доказано в условиях экспериментов in vitro) замедляет рост сосудов.
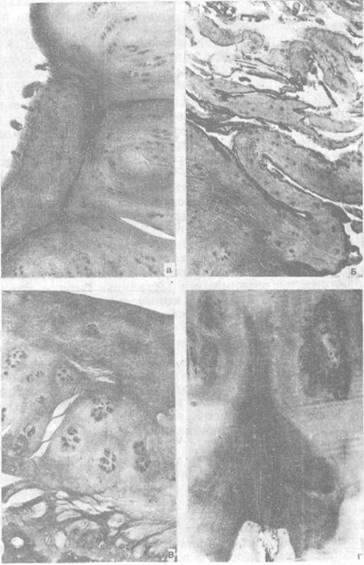
Рис. 2.3. Состояние суставного хряща при коксартрозе:
а) формирование продольных и поперечных трещин;
б) микрофрагментация;
в) демаскирование коллагеновых волокон, нарушение цитоархитектоники;
г) прорастание сосудов в хрящ, изогенные группы клеток (окраска гематоксилином и эозином, МБИ-6, ув. 80)
Имеется точка зрения, что в патологической цепи остеоартритов существенная роль принадлежит синовиальной мембране. Синовиальная оболочка при ранних стадиях остеоартрозов и в условиях активации воспалительного процесса отечна, гиперемирована. В ней определяется ворсинчатая гиперплазия от слабой до выраженной. В строме ворсин увеличивается количество фибробластов и фиброцитов. Коллагеновые волокна рыхло упакованы. Постоянным признаком является диффузная, слабовыраженная воспалительная инфильтрация, в том числе диффузная и очаговая периваскулярная инфильтрация. В состав инфильтратов входят: лимфоциты, макрофаги, плазмоциты и единичные полинуклеары (Павлова В. Н. и соавт., 1988). В условиях воспалительного процесса синовиальная ткань потребляет повышенное количество глюкозы и в ней значительно возрастает биосинтез лактата. ГАГ, синтезируемые клетками синовия при воспалении, отличаются от синтезированных нормальным хрящом качественным составом и молекулярной массой.
При остеоартрозах капсула утолщается, фиброзный слой уплотняется, в нем уменьшается количество фибробластов, но в межклеточном веществе увеличивается объем коллагеновых волокон, различающихся шириной и плотностью упаковки на отдельных участках. Кроме того, в матриксе повышается содержание неколлагеновых белков. Стадия регрессии воспалительного процесса характеризовалась снижением толщины слоя синовиоцитов, уменьшением площади сосудов на единицу площади и, зачастую, их склерозированием. Изменения синовиальной мембраны, как важной подсистемы сустава, приводят к нарушению функционирования механизма „кровеносное русло > синовиальная мембрана > синовиальная жидкость > суставной хрящ”. При этом инициирующим звеном может явиться нарушение кровообращения в капсуле как за счет кровеносного русла конечности, так и за счет локальных его нарушений в капсуле (фиброз). Нарушение функции капилляров капсулы приводит к ограничению обеспечения синовиоцитов глюкозой, аминокислотами и другими питательными и регуляторными веществами. Однако эта точка зрения имеет больше противников, чем сторонников.
В экспериментальных работах доказано, что повреждение сосудистого русла конечности замыкается цепью деструктивных изменений в суставном хряще, однако это не нашло достаточного подтверждения в клинических наблюдениях, в частности, в ситуациях, связанных с тромбофлебитами и т.п. (Freeman A. et al., 1979).
Имеется точка зрения на артрозы как на следствия воспаления в суставе. Независимо от причинных факторов, приведших к артрозам, разрушение суставного хряща постоянно инициируется воспалительными процессами, являющимися отражениями микротравмирования сустава, либо следствием инфекции. В целом, при воспалении разрушение суставного хряща возможно „через ферменты, которые возникают при воспалении”. К ним могут быть отнесены фосфатазы, катепсины, нейтральные металлопротеазы — протеогликаназы, коллагеназы и т.д. Доказано, что катаболины, в частности интерлейкин I, стимулируют образование хондроцитами металлопротеаз (Arend W. Р., Joslin F., Massoni R., 1985; Ratcliffe A., Tyler J., Hardingham T., 1986). Сам интерлейкин 1 синтезируется как в синовиоцитах, так и в хондроцитах. Его влияние на ткани сустава многообразно (рис. 2.4). Он стимулирует пролиферативные процессы в синовиальных клетках и усугубляет течение воспалительного процесса в суставе, стимулирует биосинтез простагландина Е2, оказывает влияние на иммунологические эффекты, имеющие место при остеоартрозах. Разрушение хондроцитов и продукты деструкции хряща также являются фактором, стимулирующим биосинтез интерлейкина I (Gery I., Lepe-Suniga I. L., 1984).
Существенным звеном в патогенезе заболевания может быть повышение биосинтеза простагландинов, в частности ПГЕ2, и накопление их в синовиальной жидкости, что способствует повреждению хрящевой ткани и индукции синовитов.
В настоящее время доказано, что ПГА, ПГД, ПГЕ, ПГF-2a B низких концентрациях стимулируют включение энтимидина, D3 Н-глюкозамина, С-серина, энлейцина, цитидина, глицина в хрящевую клетку, но не влияют на инкорпорацию Н-глюкозы и 1 С- ксилозы (Malemud С. I., Sokoloff L., 1977; Morasca L. et al., 1982; Kleine T.O. et al., 1983). Высокие концентрации простагландинов приводят к ингибированию метаболических процессов в хондроцитах, в частности, биосинтеза протеогликанов, при этом ПГА отличается наиболее выраженным цитотоксическим эффектом. Установлено, что простагландины могут выступать как эндогенные медиаторы в биосинтезе интерлейкина I (Kunkel S. L., Chensue S. W., Pahn S. H., 1986). В связи с этими данными, использование агентов, ингибирующих активность арахидоновой кислоты и, соответственно, простагландинов и интерлейкина I, открывает новые перспективы в лечении остеоартрозов (Loyau G., Pujol G. Р., 1990).
Ниже приведена схема многоэтапного процесса биосинтеза простагландинов (рис. 2.5) (Кудрин А. Н., Ряженов В. А., 1988).
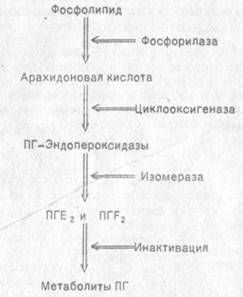
Рис. 2.5. Схема биосинтеза простагландинов и их метаболитов
Существует точка зрения о нарушении в синовиальной мембране метаболизма синовиоцитов В-типа, синтезирующих гиалуроновую кислоту, что может быть сопряжено с дезинтеграцией механизмов регуляции метаболизма В-синовиоцитов. Возникающие изменения — интенсификация или ингибирование биосинтеза вырабатываемой ими гиалуроновой кислоты — нарушают вязкость синовиальной жидкости и, соответственно, отражаются на ее функции.
В условиях нарушения организации и функционирования тканей суставов звеном, приводящим к манифестации остеоартрозов, может явиться биомеханический фактор — понижение нагрузки на сустав (иммобилизация) или повышение (гиперкинезия, физические перегрузки). Так, при обездвиженности сустава не функционирует диффузно-нагрузочный механизм питания суставного хряща, вследствие чего приток питательных веществ в хрящ резко замедляется. Кроме того, снижение кровоснабжения капсулы приводит к ингибированию функционирования синовиоцитов, что в конечном итоге отражается на составе и свойствах синовиальной жидкости.
Физические перегрузки проявляются во всех подсистемах суставного аппарата — связках, капсуле, суставном хряще, и могут стать причиной микротравматизации с последующим нарушением функционирования суставов. Это подтверждается наличием так называемых профессиональных артрозов — артроза плеча у кузнецов, лучезапястных суставов у маляров, коленного сустава у спортсменов и т. д. (Астапенко М. Г., 1975).
Имеется биомеханическая концепция развития остеоартрозов, в основе которой лежит повреждение коллагеновых волокон хряща, за счет чего нарушается его способность переносить нагрузки (Schofield J.D., Weightman В., 1978). Дальнейшим звеном в этой цепи патогенетических преобразований может быть нарушение связи протеогликанов с коллагеном и вымывание их из матрикса. Однако данные наших исследований, проводимых ранее и в настоящее время, с целью выяснить особенности перестройки матрикса хрящей при экстремальных воздействиях (Панков Е. Я., Малышкина С. В., Дедух Н. В., 1985), данные литературы (Maroudas А., 1980) свидетельствуют о том, что коллагеновый каркас может быть признан наиболее стабильным компонентом матрикса суставного хряща, обладающим большим резервом прочности. Таким образом, по нашим представлениям, в основе адаптационных процессов перестройки, развивающихся при старении хрящей и в условиях предпатологии и патологии, прежде всего лежат качественные изменения состава ГАГ и их ориентационной упорядоченности, которые необходимо рассматривать в неразрывном единстве с учетом специфики и иерархии их взаимодействия с другими макромолекулами. Именно за счет ГАГ обеспечивается гомеокинез хрящевого матрикса в течение жизни, что в совокупности и обуславливает высокую способность хрящевой ткани к адаптации. В связи с этим при оценке влияния лекарственных препаратов на хрящи ГАГ могут быть выделены как тканеспецифические маркеры, позволяющие тестировать препараты по наличию или отсутствию в них хондропротективного действия.
В основе поступления питательных и регуляторных веществ из синовиальной жидкости в суставной хрящ лежит диффузионно-нагрузочный механизм, функционирующий только в условиях переменной нагрузки, приходящейся на суставной хрящ. Суставной хрящ при нагрузке „как губка” впитывает синовиальную жидкость и отдает ее при давлении. Дискутабельным является вопрос поступления в суставной хрящ веществ субхондральным путем, то есть через сосудистые терминалии, подходящие в виде петель к зоне кальцифицирующегося хряща. Считается, что этот путь миграции возможен до определенного возраста и в отсутствие дистрофических изменений в организации базофильной линии, отделяющей некальцифицированный хрящ от кальцифицированного, которой принадлежит исключительная роль в функционировании диффузионно-нагрузочного механизма транспорта в хрящ питательных и регуляторных веществ. По данным Н. А. Слесаренко (1987), эта структура выполняет роль своеобразной регулирующей проницаемость мембраны, контролирующей поступление в хрящ веществ. В норме эта линия не является сплошной, она имеет вид сита, в котором функции ячеек выполняют хондроциты, пересекающие эту линию и распределяющиеся как в зоне некальцифицированного, так и кальцифицированного хрящей. Суставной хрящ в зрелом возрасте питается только через синовиальную мембрану. При этом скорость проникновения питательных и регуляторных веществ зависит от их молекулярной массы, определяется электрическим зарядом, толщиной хряща и, соответственно, степенью подвижности сустава (Maroudas А., 1973).
Субхондральная кость рассматривается нами как звено в патогенезе дистрофических заболеваний суставов. Доказано, что при артрозах в трабекулах субхондральной кости, прилежащей к суставному хрящу, повышается содержание оксипролина, гексозаминов, и кроме того, удлиняется по времени течение метаболических процессов, вследствие неадекватной нагрузки, падающей на кость из-за истончения и разрушения хрящевого покрытия. Подхрящевая костная пластинка утолщается (склерозируется), но, зачастую, в ней обнаруживаются микротрещины. В том случае, если течение артрозов сопровождается артритами, то субхондральная пластинка резко истончается. Субхондральная кость претерпевает реактивные изменения: в ней обнаруживаются микропереломы трабекул, псевдокисты. Безусловно, изменения трабекулярной организации субхондральной кости приводят к нарушению прочностных свойств суставного хряща.
Данные о кровоснабжении артротических головок бедренной кости неоднозначны. Ряд работ объединяет утверждение о том, что при артрозах либо резко уменьшается кровоснабжение субхондральной кости, либо оно сохраняется на прежнем уровне. Высказано мнение о венозном застое в этих отделах сустава. Мы наблюдали различные патогенетические ситуации: как увеличение сосудистых терминалий, непосредственно примыкающих к суставному хрящу, так и резкое снижение их на единицу площади, зачастую сопровождающееся венозным полнокровием. По всей вероятности, этот факт в целом связан с метаболическим состоянием организма, давностью развития заболевания и должен рассматриваться индивидуально в каждом конкретном случае.
Прочностные свойства кости также изменяются при наличии сопутствующих заболеваний — нарушениях белкового или минерального обмена при болезнях желудка, почек, печени, нарушении секреции поджелудочной и других эндокринных желез (Parsons I. A., Zanelli V., 1980; Deluca Н. F., Ghazarian J. G, 1980; Macintyne I. et al, 1980).
Манифестация остеоартрозов сопряжена с эрозированием суставного хряща, при этом снижается его масса, на участках обнажается костная ткань. Репаративные процессы заключаются в формировании в суставном хряще очагов гиперплазии хондроцитов, располагающихся в расширенных капсулах в виде изогенных групп.
Суммируя в целом патогенетические ситуации, связанные с негативными изменениями структурной организации и метаболизма тканей суставов, имеющих место при остеоартрозах, отметим, что в патогенез вовлекаются все подсистемы сустава, однако наиболее выраженная степень нарушений прослеживается в суставном хряще (рис. 2.6).
В связи с этим морфологические способы определения стадий остеоартрозов основаны на анализе состояния суставного хряща. Выделяют три или четыре стадии заболевания (Otte Р., 1969; Mohr W., 1984; Павлова В. Н. и соавт., 1988). В схематическом изображении 4 стадии остеоартроза выглядят следующим образом (рис. 2.7): стадия 1 — поверхностная зона в суставном хряще разволокнена; стадия 2 — глубокие трещины в суставном хряще, снижение высоты, нарушение цитоархитектоники, появление изогенных групп клеток, содержащих четыре и более хондроцитов; стадия 3 – потеря некальцифицирующегося хряща, нарушения в зоне кальцифицирующегося; стадия 4 — отсутствие хрящевого покрытия, открытые межтрабекулярные пространства. Зачастую исследователю необходима более детальная оценка состояния суставного хряща, особенно при испытаниях фармакологических агентов. В этом случае может быть успешно использован метод клинико-морфологических сопоставлений, предложенный В. Н. Павловой и соавт. (1988). Первой стадии заболевания присущи сохранение общей структуры суставного хряща, фибрилляция поверхностной зоны; уменьшение содержания гликозаминогликанов; сохранение хондроцитами функциональной активности (содержание рибснуклеопротеидов, НАД- и НАДФ диафораз). При второй стадии остеоартроза обнаруживаются две разновидности изменений. При первой — в суставном хряще сохраняется поверхностная зона, но в ней уменьшается содержание гликозаминогликанов; увеличивается число лакун без хондроцитов и появляются клетки с пикнотичными ядрами и высокой активностью кислой фосфатазы; при второй разновидности обнаруживается частичное разрушение поверхностной зоны за счет узур и скоплений хондроцитов по их краям; уменьшение содержания гликозаминогликанов во всех зонах; снижение функциональной активности хондроцитов (уменьшение содержания рибонуклеопрстеидов, НАД- и НАДФ диафораз, лактатдегидрогеназы, сукцинат- и глюкозо-6-фосфатдегидрогеназ, гликогена). В хондроцитах увеличивается содержание кислой фосфатазы, уменьшается содержание гликозаминогликанов. Характерными структурными повреждениями суставного хряща при третьей стадии остеоартрозов является отсутствие поверхностной и промежуточной зон, глубокие узуры со скоплениями хондроцитов по их краям, резкое уменьшение содержания гликозаминогликанов, увеличение количества хондроцитов с пикнотичными ядрами и высоким уровнем в клетках кислой фосфатазы.
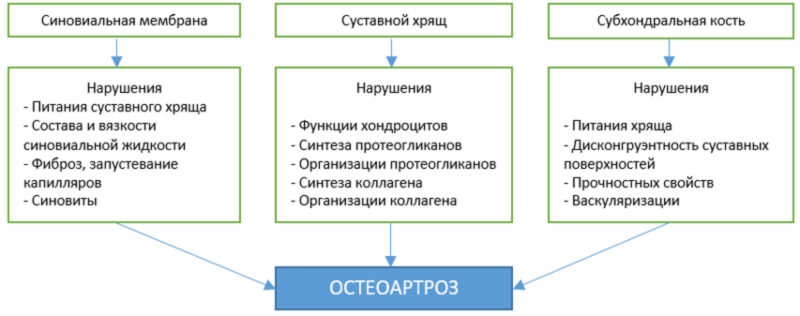
Рис. 2.6. Варианты структурных нарушений в тканях суставов при остеоартрозах
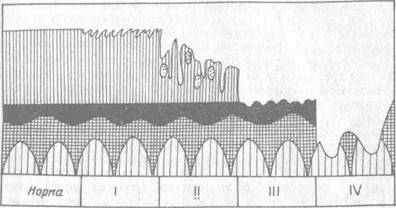
Рис. 2.7. Стадии структурных изменений в суставном хряще и субхондральной кости (пояснение в тексте)
Дистрофические изменения не ограничиваются только тканями сустава. В крови у больных остеоартрозами общее количество белков в большинстве случаев соответствует норме, но происходит их перераспределение. Так, снижается уровень альбуминов при относительном повышении содержания глобулинов (главным образом, -глобулина) (Дрейер А. Л., Антипина А. Н., Юшина Т. К., 1971). Отмечено накопление в плазме гликопротеинов, гексозаминов и сиаловых кислот, изменение общей активности ЛДГ и ее изоферментного спектра. В моче снижено содержание 17-кетостероидов.
СПИСОК ЛИТЕРАТУРЫ
- Астапенко М. Г. Современное состояние вопроса о патогенезе и патогенетической терапии деформирующего артроза/ Вопросы ревматизма. — 1975. №3.-С. 75-80.
- Дедух Н. В. Морфологические аспекты воздействия гормонов на суставной хрящ в онтогенезе: Дис. д-ра биол. наук. — X., 1988. — 360 с.
- Дедух Н. В., Панков Е. Я. Гормональная регуляция процессов развития и роста хрящей//Успехи совр. биологии — 1988. — N° 6. -С. 454 — 469.
- Дрейер А. Л., Антипина А. Н., Юшина Т. К. Деформирующий артроз тазобедренного сустава: Тр. 2-го Всерос. съезда травматологов-ортопедов. -Л 1971.-С. 150- 155.
- Костерин С. Б., Кулиш Н. И., Дедух Н. В., Тарасенко В. И., Истомин А. Г. Дезинтеграция эндокринного статуса организма при идиопатическом коксартрозе// Актуальные вопросы травматологии и ортопедии: Материалы Первой науч.-практич. конф. травматологов-ортопедов Ленинабад, обл. и представителей союз. респ. — Душанбе, 1991. — Ч. 2. — С. 60 — 62.
- Кулиш Н. И., Танькут В. А., Костерин С. Б., Тимошенко О. П., Леонтьева Ф. С. Роль нестероидных противовоспалительных препаратов в комплексном лечении коксартроза (обзор литературы) // Ортопедия, травматология и протезирование. — 1991. — № 9. — Р. 71 — 72.
- Павлова В. Н., Копьева Т. Н., Слуцкий Л. Т., Павлов Г. Г. Хрящ. — М.: Медицина, 1988. — 320 с.
- Панков Е. Я., Малышкина С. В., Дедух Н. В. Структурные изменения клеток и межклеточного вещества суставного хряща при действии экстремальных низких температур //Ультразвук и криогенный метод в оперативной ортопедии: Сб. науч. тр. — Саратов, 1985. — С. 25 — 33.
- Сименач Б. И., Полозов Ю. Г., Панков Е. Я., Шевченко С. Д. Наследственно предрасположенные заболевания тазобедренного сустава (концептуальная модель) //Ортопедии, травматология и протезирование. — 1990. — № 12.-С. 72-73.
- Слесаренко Н. А. Структурные адаптации костной системы при различной двигательной активности: Автореф. дис. д-ра биол. наук. — М., 1987.- 32 с.
- Хадхази Ч., Дедух Н. В. Влияние инсулина на дифференцировку хряща in vitro //Бюл. эксперим. биологии и медицины. — 1988. — № 2 — С. 219 -221.
- Чепой В. М. Диагностика и лечение болезней суставов. — М: Медицина, 1990. — 303 с.
- Adams М. А., Grant М. D., Но A. Cartilage proteoglican changes in experimental canine osteoartritis //J. of Rheumatology. — 1987. — (Suppl. 14). — Vol. 14.-P. 107- 109.
- Arend W. P., Joslin F. G„ Massoni R. F. Characteristics of Chondrocite Responses to a Human Interleukin i Like Factor //Clin. Immunologie immuno- pathologie. — 1985. — Vol. 36. — P. 358 — 370.
- Bollet A. J. Stimulation of Proteinchondroitinsulfate Sinthesis by Normal and Osteoarthritic Articular Cartilage //Arthritis and Rheum — 1968. — N 11.-P. 663- 667.
- Collins E. G„ Anilane T. The response of costal cartilage to changes in hormonal environment //Experiencia. — 1959. — N 15. — P. 116 — 117.
- Deluca H. F., Chazarian T. G. The Role of Vitamin D and its Metabolites in Calcium and Phosphate Metabolism //Klinische Osteologie. — 1980. — N 8. — S. 173- 192.
- Dorwart В. B., Schumacher H. R. Joint effusions, chondrocalcinosis and other rheumatic manifestations in hypothyroidism //Amer.J. Med. — 1975. — Vol. 59.-P.780-790.
- Gery J., Lepe-Zuniga J. L. Interleukin I: Unigueness of its Production and Spectrum Activities //Lymphokines. — 1984. — N 9. — P. 109 — 125.
- Heine J. Uber die Artritis Deformans //Virchows Arch. — 1926. — Vol. 26. — P. 521 — 663.
- Hough A. J., Webber R. J. Aging Phenomena and Osteoartritis: Cause or Coisedence //Annals of Clin, and Lad. Sci. — 1986. — Vol. 16, N 6. — P. 502 -510.
- Huth F., Weller-Boothe В. M. Histomorphologische und morphometri- sche Untersuchungen an Synovialmembranen von Kniegelenken zur Frage einer diabetischtn Arthropathie //Z. Orthop. — 1979. — Vol. 117. — P. 287 — 292.
- Freeman M. A. R. Adult Articular Cartilage. — London: Pitman, 1979. — 560 p.
- Frykberg R. G., Kozak G. P. Neuropathic arthropathy in the diabetic foot //Amer. Fam. Physician. — 1978. — Vol. 17. P. -105 — 113.
- Kleine T. O., Jungmann U., Schippers K. et al. The effect of prostaglandins (A, B, D, E, F) and 3, 5-cyclic nucleotides (cAMP, cGMP, cCMP, cIMP, cUMP) on the biosynthesis of proteochondroitin-4, — 6-sulfate and hyaluronate in hyaine cartilage //12-th symposium of the European society of osteoarthro- logy: Biology of the cartilage. — Debrecen, 1953. — P. 33.
- Kofoed J. A., Bossini C. F., Tocci A. A. The concentration of glycosaminoglycans in the skin and tracheal cartilage of normal and orchidectomised rats injected with testosterone //Acta Endocrinologies. — 1970. — Vol. 63, N 2. — P. 193-198.
- Kunkel S. R., Chensue S. V., Hahn S. H. Prostaglandins as Endogenous Mediators of Interleukin i Production //J. Immunolog. — 1986. — Vol. 136. — P. 186- 192.
- Lawrence I. S. Genetic aspects of primary osteoarhrosis //Abstracts of the 7 European Rheumatology congres. — Brighton, 1971.
- Lebovitz H„ Eisenberth G. Hormonal regulation of cartilage growth and methabolism //Vitam. Yjrm. — 1975. — Vol. 33. — P. 575 — 648.
- Lipson R. L., Williams L. E. The „connective tissue disorder» of hyperparathyroidism //Arthritis Rheum. — 1968. — N 9. — P. 198 — 205.
- Loyau G., Puzol T. P. Tht Role of Cytocines in the Development of Osteoarthritis //Scand. J. Rheumatology. — 1990. — (Suppl. 81). — P. 8 — 12.
- Macintyre V., Evans I. M. A., Galante L. S., HiJIyard C. G. Calcitonin: Discovery, Physiology and Effects on Calcium and Phosphate Metabolism //Kliniche Osteologie A. — Berlin; Heidelberg; New York: Springer Verlag, — 1980. — P. 197-212.
- Malemud C„ Sokoloff L. The effect of prostaglandins on cultured lapine articular chondrocytes //Prostaglandins. — 1977. — Vol. 13, N 5. — P. 845 — 860.
- Maroudas A. Metabolism of cartilaginous tissues; a quantative approach (Stud. Joint Disease). — Cambridge, 1980. — P. 59 — 86.
- Mohr IV. Arthritis Patologie der Gelenke und Neichteiftumoren. Pathologie der Gelenke und Weichteiltumoren I. Berlin; Heidelberg; New York; Tokyo: Springer Verlag.1984. — S. 133 — 228.
- Mohr IV. Arthrosis deformans //Specielle Pathologische Anatomie. — Berlin; Heidelberg; New York; Tokyo: Springer Verlag, 1984. — P. 257 — 350.
- Morasca L„ Curatolo G„ Amato M., Donati B. Metabolic effects and byosynthesis of prostanoids in culture of articular chondrocytes //Biol. cell. — 1982.-Vol. 45, N 1.-P. 58.
- Ofte P. Die Konservative Behandlung dei Huft und Kniearthrose und ihre gefahren //Dtsch Med. J. — 1969. — Vol. 20. — S. 604 — 609.
- Parsons J. A., Zanelli J. M. Physiological role the parathyreoid glands /Klinische osteologie A. — Berlin; Heidelberg; New York: Sprihger Verlag. — 1980. — S. 135- 164.
- Pewuim T., Adams J. В. Estrogen metabolism in the developing chick embryo //Endocrint Soc. Austral. Proc. — 1979. — Vol. 22. — Suppl. 2. — P. 44-46.
- Ratcliffe A., Tyler T. A., Harclingham T. E. Articular Cartilage Cultured with Interleukin I //Biochem. J. — 1986. — Vol. 238. — P. 571 — 581.
- Rosner J. A., Vanni A., Malemud C. J., Boja B., MoskowiU R. IV. Estradiol receptors in articular chondrocytes //Biochem. Biophys. Res. Communs. — 1982. — Vol. 106, N 4. — P. 1378 — 1382.
- Roungly R. J. Structural Changes in the Proteoglycans of Human Articular Cartilage During Aging //J. of Rheumatology. — 1988. — (Suppl. 14). — Vol. 14.- P. 14- 15.
- Salmon IV. D., Du Vail M. K., Thompson E. V. Stimulation by insuen in vitro of incorporation of 35S-sulfate and 14C-leucine into protein polysaccharide complexes, 3H-uridine into RNA and 3H-thymidine into DNA of costal cartilage from hypophysectomised rats //Endocrinology, — 1968. — Vol. 82, N 3. — P. 493 — 499.
- Sandy D, Barrach J., Flannery C. R„ Plaac A. H. K. The Biosinthetic Response of the Mature Chondrocete in Earle Osteoarthritis //J. of Rheumatology. — 1987. — (Suppl. 14). — Vol. 14.
- Sapolsky A., Malemud C., Sheff M. The Proteoglycans from Human Cartilage and Cultured Rabbit Chondrocytes and its Relation to Osteoartritis 11 J. of Rheumatology. — 1987. — (Suppl. 14). — Vol. 14. — P. 33 — 35.
- Schofield J. D„ Weightman B. New Knowlege of conntctive tissue Aging //J. Clin. Pathologie (Roy Coll. Pathologie). — 1989. — (Suppl. 12). — Vol. -P. 174- 190.
- Silberberg R., Hasler V., Silberberg M. Submicroscopic Response of articular cartilage of mice treated with estrogenic hormone //Amer. J. Pathologie. — 1965. — Vol. 40, N 2. — P. 289 — 3C5.
- Stricland A. L„ Sprintz H. Studies of the influense of estradiol and growth hormone on the hypophysectomised immature rat ehihhyseal cartilage growth plate //Amer. J. Obstet. Gynecologie. — 1973. — Vol. 115, N 4. — P. 471 — 477.
- Takanashi Y., CorvolM. Z., Tsagris L., Corrascola A. et al. Testosterone methabolism in prepubertal rabbit cartilage //Mol. Cell. Endocrinologie. — 1S84. — Vol. 35, N 1. — P. 15-24.
- Tarsoly E. Histologische und Enzimhistochemische Untersuchungen uber die Alterung des Gel enkknorpels unter Testosteron-verarbeichung bei Normalen und Hypophysectomierten Ratten //Anat. Res. Erganzungsh. — 1975.-Bd. 138. -S. 403- 411.