Анализ данных об основных звеньях нарушений структурных и метаболических процессов в тканях суставов позволяет заключить, что принципы фармакологической коррекции остеоартрозов состоят в следующем:
— блокирование воспалительных процессов в суставе;
— нормализация биосинтетических процессов в хондроцитах;
— ингибирование катаболических процессов в хрящевой ткани;
— нормализация секреции синовиальной жидкости (количественно и качественно);
— оказывает протекторного действия при повреждении хрящей.
В настоящее время только воспалительные процессы, по образному выражению F. J. Wagenhauser (1984), „подобно вершине айсберга выделяющиеся из общей картины заболевания”, имеют достаточно разработанные методы лечения.
Для фармакологической коррекции остеоартрозов, а также симптоматической терапии могут быть использованы три группы лекарственных средств: стероидные и нестероидные противовоспалительные средства (СПВС и НПВС), а также хондропротективные препараты.
Данные литературы о названных выше группах препаратов, касающиеся прикладных аспектов при остеоартрозах, противоречивы. В частности, имеется двойственная трактовка влияния СПВС и НПВС на метаболизм суставного хряща и оценки их хондропротективных свойств. Зачастую экспериментальные данные не подтверждаются клиническими наблюдениями. В связи с этим интерес представляют фармакологические особенности воздействия стероидных и нестероидных противовоспалительных препаратов, их влияние на метаболизм и функции суставного хряща, условия рационального использования при лечении остеоартрозов, а также характеристики существующих и созданных отечественных хондропротекторов, являющихся, на наш взгляд, наиболее приемлемыми в лечении дистрофических заболеваний суставов.
Стероидные противовоспалительные препараты
Одним из первых стероидных препаратов, использованных для внутрисуставных инъекций с целью купирования воспалительного процесса, был кортизон. Однако введение его в сустав, выполненное в 1950 году, было неэффективно. Более удачной оказалась попытка использования кортизона ацетат, а в последующем и гидрокортизона ацетат. В настоящее время получено и оценено свыше 10 стероидных препаратов, которые используются в ревматологии, ортопедии и травматологии для купирования синовитов, бурситов, тенденитов, остеоартритов и других заболеваний как суставных, так и не суставных тканей. Препараты кортикостероидов и их терапевтические дозы, рекомендованные для внутрисуставного введения, представлены в табл. 3.1. В последние годы ведутся широкие разработки по использованию этих препаратов в виде липосом. Показано, что стероиды, вводимые в форме липосом, оказывали выраженное противовоспалительное действие и пролонгированный эффект [Shaw 1. Н. et al., 1979; Smith D. L. et al., 1980].
Фармакокинетика и системный эффект кортикостероидов
Известно, что стероиды, введенные в сустав, обнаруживаются в плазме крови через большой интервал времени, чем при пероральном введении. Так, после инъекции в сустав 14С-гидрокортизона установлено, что он сохраняется в синовиальной жидкости от 60 до 170 мин [Peterson R. F., Black R. I., 1959]. При этом в плазме крови увеличивается уровень 17-дегидрокортикостероидов и подавляется содержание свободного кортизола, что свидетельствует об ингибировании гипоталамо-гипофизарно-адреналовой системы по принципу обратной связи. Продолжительность подавления биосинтеза кортизола различна. Так, при использовании метилпреднизолона ацетата (80 мг) уровень кортизола в плазме снижается в течение 3 — 7 дней [Koehler В. Е., Urowitz Н. В., Kilinger D. W., 1974]. Воздействие гидрокортизона приводит и к другим нарушениям эндокринного баланса организма за счет ингибирования целого ряда гормонов, регулирующих процессы роста, развития и дифференцировки хондроцитов (рис. 1).
Таблица 1.
Препараты кортикостероидов, рекомендованные для внутрисуставных инъекций: дозы и продолжительность действия при ревматоидных синовитах коленных суставов [По Gray R. G., Gottlieb N. L., 1983]
| Исходное название | Патентованный препарат | Доза, мг | Продолжительность действия, дни |
| Бетаметазона ацетат и фосфат Гидрокортизона ацетат | Целестон-солуспен Аббокорт | 0,6 — 5,0 37,5 -100 | 96-40 |
| Гидрокортизона бутилацетат (ТВА) | — | 25,0-37,5 | 12-30 |
| Дексаметаэона ацетат | Декардон А | 5 | 8 |
| Метилпреднизолона ацетат | Депо-медрон | 30-40 | — |
| Преднизолона ацетат | Метикортелон | 30 | 8 |
| Преднизолона ТВА | Хидельтера ТВА | 20-40 | 15 |
| Триамцинолона ацетонид | Кеналог-40 | 10-30 | 14 |
| Триамцинолона гексацетонид | Аристопан | 10-40 | 21; 59-80 |
| Триамцинолона диацетат | Аристокорт форте | 20-30 | 8 |
Рис. 1. Влияние гидрокортизона на эндокринный баланс организма. Стрелкой обозначено ингибирование
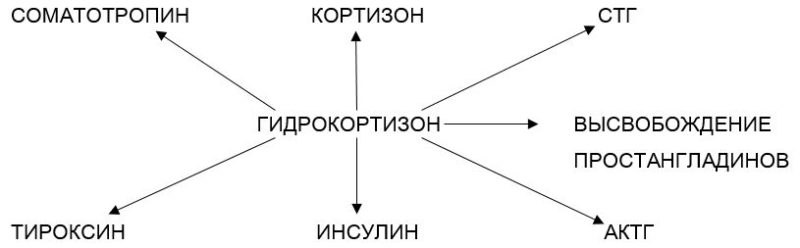
Известно, что гидрокортизон пермиссирует эффекты других гормонов — адреналина, глюкагона, пролактина, также влияющих на метаболизм хрящевой ткани. —
Уровень абсорбции препаратов тканями суставов находится в строгом соответствии с его растворимостью в воде и зависит от состояния синовиальной мембраны [Gray R. G., Gotlied N. L., 1983; Эррера О. А., 1990]. Не рекомендуется вводить кортикостероидные препараты в два и более сустава одновременно в связи с резким ингибированием гипоталамо-гипофизарно-адреналовой системы.
Биологическое действие кортикостероидов на уровне целостного организма, в том числе и ткани суставов, полностью не выяснено.
Среди высокоселективных эффектов стероидных гормонов особый интерес представляет их воздействие на биосинтез специфических белков, принимающих участие в дифференцировке и гипертрофии хондроцитов: фосфорилазы, лактатдегидрогеназы и щелочной фосфатазы [Silberman М., Joister Z., Lewinson D., 1977].
Глюкокортикоиды приводят к нарушению формирования коллагеновых волокон, что влечет за собой снижение роста и минерализации хрящей. Несколько различаются по характеру действия гидрокортизон и преднизолон. Если первый резко ингибирует биосинтез ГАГ в хрящах, то последний в экспериментах на хрящевой модели бедренной кости приводил к увеличению содержания ГАГ в эксплантатах как за счет усиления биосинтетических процессов в хондроцитах, так и снижения выхода ГАГ из эксплантатов в культуральную среду.
И еще на одном аспекте влияния глюкокортикоидных препаратов необходимо остановиться. В эксперименте доказано, что введение гидрокортизона ацетат беременным крысам-самкам на этапе формирования конечностей у плодов приводит к снижению плотности хондроцитов в гиалиновом суставном хряще плодов и к атрофическим изменениям хондробластов [Дедух Н. В., 1988]. В цитоплазме клеток снижается объемная доля мембранных органелл: эндоплазматического ретикулума, митохондрий, комплекса Гольджи. Выраженные нарушения прослеживаются в матриксе хрящей — уменьшается содержание и нарушается распределение гликозаминогликанов и гликопротеинов. Эти данные должны приниматься во внимание врачами при назначении СПВС беременным.
Природу и механизм влияния кортикостероидов на суставной хрящ необходимо рассматривать в тесной связи с наличием в хондроцитах специфических рецепторов [Adolfe М., Blondelon D., Lechat Р., 1980]. В связи с этим действие кортикостероидов на суставной хрящ может быть реализовано как путем непосредственного влияния на хрящевую клетку, так и посредством подавления биосинтеза гормонов, оказывающих анаболическое действие на хондроциты (СТГ, соматомединов и тироксина) (рис. 1).
Важно! В целом, действие глюкокортикоидов на суставной хрящ и синовиальную мембрану носит ингибирующий характер.
В условиях культуры тканей, полученной из синовия человека, показано, что гидрокортизон в дозе 0,5 мкг/мл ингибирует биосинтез ПГЕ2 и гиалуроновой кислоты, что лежит в основе его противовоспалительного действия [Yaron М., Yaronl., 1983]. Авторы рекомендуют использовать модель культуры тканей для тестирования фармакологических препаратов-антифлогистиков.
Доказано, что в основе механизма действия кортикостероидов лежит ингибирование циклооксигеназного и липооксигеназного путей метаболизма арахидоновой кислоты. Это приводит к блокированию в ревматоидной синовиальной оболочке биосинтеза простагландинов и ингибированию образования медиаторов воспаления, в частности, лейкотриенов, факторов, влияющих на лейкоциты [Newcombe D. S., Ishikawa Y., 1976].
Кроме того, в очаге воспаления в синовиальной мембране стероиды подавляют функции Т-лимфоцитов, формирующих инфильтраты [Parrillo J.E., Fanci F. S., 1978; Saxon A. et al., 1977].
Следующий важный аспект действия кортикостероидов. Они легко связываются с клеточными мембранами и мембранными органеллами клеток, а именно, с их билипидным слоем и оказывают влияние на расположение в нем липидов, конфигурацию и, соответственно, выполняемые функции.
Доказано, что стероидные препараты, проникая в цитоплазму клеток, стабилизируют мембраны лизосом и подавляют выход из них гидролитических ферментов, способствуя тем самым уменьшению проявления деструктивных изменений в матриксе хрящей [Gray R. G., Gottlied N. L., 1983].
Кортикостероидные препараты применяют в случаях артрозов, отягощенных артритами. Рядом авторов показана их эффективность в купировании воспалительного процесса при спондилоартрозах, остеоартритах коленного и тазобедренного суставов [Hollander J L., 1970, 1979; Mankin Н. J., Conger X. А., 1966; Sacks S., 1955; Stradbery В., 1965 и др.]. Наряду с отмеченными положительными сторонами действия кортикостероидов, по сей день является дискуссионным вопрос о возможных побочных эффектах действия на суставной хрящ практически всех имеющихся в арсенале медицины стероидных препаратов. Так, показано, что даже единичные инъекции гидрокортизона ацетата вызывают снижение биосинтеза РНК, протеогликанов и белков [Mc Cluskey R. J., Thomas L., 1959; Mankin H. J., Conger К. A., 1966]. Еженедельные инъекции (от 2 до 12 нед.) приводят к выраженной дезорганизации суставного хряща. В нем уменьшается количество хондроцитов на единицу площади, в матриксе снижается содержание протеогликанов, белков, в том числе и коллагеновых, что приводит к разволокнению матрикса и формированию микрокист [Дедух Н. В., Панков Е. Я., 1988; Behrens F., Shepard N., NitehellN. 1976].
Необходимо отметить и следующие особенности воздействия препаратов этого ряда на суставной хрящ в зависимости от возраста (эксперименты на животных). Так, у животных молодого возраста низкие концентрации гидрокортизона ацетата вызывали реактивные изменения в хондроцитах, которые могут быть охарактеризованы как адаптивные. Высокие дозы приводили к инволютивной атрофии и деструкции клеток и матрикса (рис. 3.2). На зрелые суставные хрящи низкие дозы гидрокортизона практически не оказывали влияния, а высокие приводили к выраженным дистрофическим и деструктивным изменениям в клетках и матриксе, вплоть до дезорганизации этой структуры. По всей видимости, отмеченные выше нарушения восприятия гормонального сигнала хондроцитами связаны с их инволютивными преобразованиями, в том числе и затрагивающими систему рецепторов. Течение восстановительных процессов в суставных хрящах также зависит от зрелости животных. Так, у молодых животных через 6 мес. после отмены препарата обнаружено увеличение биосинтеза ДНК и протеогликанов в хондроцитах, сопровождающееся последующим восстановлением макромолекулярной организации матрикса.
Рис. 2. Нарушение структурной организации суставного хряща под влиянием гидрокортизона ацетата:
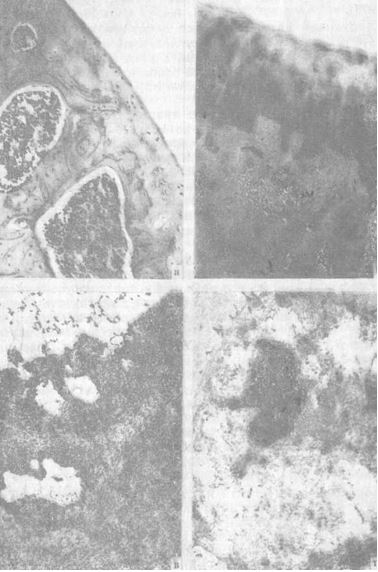
а) нарушение цитоархитектоники, гипоклеточность; окраска гематоксилином и эозином, (МБИ-6, ув. 80);
б) усугубление дистрофических изменений, отсутствие клеток в поверхностной и частично в средней зонах, гематоксилин и зозин (МБИ-6, ув. 90);
в) некроз клеток в поверхностной зоне (контрастировав по Рейнольдсу, ЭМВ-100БР, ув. 7200);
г) нарушение организации хондроцита, отсутствие мембранных органелл в цитоплазме, разрастание элементов цитоскелета (контрастировано по Рейнольдсу, ЭМВ-ЮОБР, ув. 12600)
Инъекции в сустав триамцинолона ацетонида, производимые 1 раз в неделю в течение 2 — 6 нед. проявлялись в суставном хряще комплексом как макроскопических (истончением хрящевого покрова, фибрилляцией, формированием трещин и щелей), так и микроскопических изменений (снижением плотности хондроцитов на единицу площади и наличием комплекса деструктивных нарушений в сохраненных). То есть налицо все признаки артропатии [Moskovitz R. W. et аl.,1970]. Однако в условиях моделирования в суставах синовита и остеоартроза триамцинолон снимал воспалительный процесс, не вызывая грубых деструктивных изменений в суставном хряще, но все же в матриксе при использовании этого препарата выявлено снижение метахромазии и содержания протеогликанов [Goldberg G. М., Moskovitz R. W., Schwab W., 1976].
Под действием дексаметазона ТВА у зрелых кроликов в коленном суставе обнаружены атрофические изменения, сопровождающиеся отложением гидроксиапатита [Тепепbaum J., 1981].
Имеются данные (макро- и микроскопических исследований) о безвредности применения метилпреднизолона при введении его в суставы мартышек [Gibson N., 1977]. При испытании эффекта преднизолона в условиях культуры ткани (эксплантаты суставного хряща) было выявлено, что в концентрации 0,01 и 10 мг/мл он не оказывал ингибирующего влияния на рост эксплантатов и повышал в них содержание ГАГ, что было более значимо в условиях использования более высокой концентрации [Karzel К., Breuer N. А., 1988].
Таким образом, данные, полученные при изучении влияния стероидных препаратов на суставной хрящ, противоречивы. Они пессимистичны при оценке действия на суставной хрящ грызунов и более оптимистичны при анализе воздействия на суставы обезьян. Однако, в целом, использование этих препаратов, на наш взгляд, целесообразно чередовать с другими лекарственными веществами, не нарушающими организации суставного хряща или оказывающими стимулирующее воздействие на биосинтетические процессы в этой структуре.
Нестероидные противовоспалительные препараты
Нестероидным противовоспалительным средствам с клинической точки зрения присущ ряд общих черт [Лепахин В. К., Белоусов Ю. Б., Моисеев В. С., 1988]: не специфичность противовоспалительного действия, то есть ингибирование воспалительного процесса независимо от его этиологических и нозологических особенностей; сочетание противовоспалительного, болеутоляющего и жаропонижающего действий; относительно хорошая их переносимость по сравнению со стероидными препаратами благодаря быстрому выведению из организма; ингибирующее действие на агрегацию тромбоцитов и идентичность механизма фармакологического действия.
В последние годы в экспериментальных и клинических условиях было получено и апробировано большое количество нестероидных противовоспалительных средств, рекомендованных для лечения остеоартрозов, сочетающихся с артритами. Это производные индолилуксусной кислоты (индометацин, сулиндак и др.); алкановых кислот (бруфен, ибупрофен, вольтарен (диклофенак) и др.); еноловой кислоты (пироксикам) и др. Но и по сей день не угасает интерес к наиболее часто и давно используемым лечебным средствам: производным салициловой кислоты — ацетилсалициловой кислоте и салицилату натрия, что обуславливает проведение углубленных научных и экспериментальных разработок по изучению действия этих препаратов на ткани суставов. Данные препараты биодоступны. Максимальная концентрация их в плазме крови наблюдается через 1 — 2 ч после введения [Чекман И. С. и др., 1986]. Однако в синовиальной жидкости высокий уровень салицилатов фиксируется после того, как их концентрация падает в плазме крови [Soren А., 1977] (данные получены после однократного испытания дозы 600 мг).
Противовоспалительные свойства салицилатов доказаны на адекватных экспериментальных моделях на животных, и кроме того, положительный эффект был зарегистрирован у человека. Препараты в дозах 0,6 — 1,0 г подавляют воспалительный процесс за счет понижения проницаемости сосудов, разобщения окислительного фосфорилирования, ингибирования биосинтеза простагландинов, сульфатов и гликозаминогликанов, стимуляции созревания коллагена. Они обладают слабо выраженным иммунодепрессивным действием.
Однако до настоящего времени отсутствуют обобщенные данные о специфике влияния салицилатов на суставной хрящ, хотя их эффект изучали как в условиях in vitro, так и in vivo. Показано, что в культурах хондроцитов ацетилсалициловая кислота и салицилат натрия в дозах 5, 25, 100 и 160 мг/мл вызывали значительное и независимое от дозы снижение уровня включения Н-тимидина в ДНК и биосинтеза протеогликанов. Биосинтез коллагена при этом практически не изменялся [Palmoski М., Brandt К. D.,1983; Bassler С., Henrotin J., Franchimont P., 1990]. Что касается салицилата натрия, то ингибирование биосинтеза протеогликанов в культуре хрящевой ткани, полученной из зачатков конечностей куриных эмбрионов и грызунов, было доказано лишь в условиях использования концентраций, близких к цитотоксическим [Wiger R., Stottum A., Brunbort G., 1988]. Однако имеются данные наблюдений о том, что терапевтическая концентрация салицилата натрия подавляла включение 35S04 в ГАГ [Hess Е. V., Herman Н., 1986]. Обнаружена особенность действия салицилатов в зависимости от состояния суставного хряща: наиболее уязвимым к действию салицилатов суставной хрящ становился в условиях атрофических и арт- розных изменений [Palmoski R., Brandt К., 1980, 1982]. В этом случае ингибирующий эффект ацетилсалициловой кислоты на биосинтез ГАГ был значительно выше, чем у здоровых особей. Салицилаты, по наблюдению G. Wilhelmi (1978), утяжеляли протекание спонтанных остеоартрозов у мышей линии C57BL. В условиях экспериментальной иммобилизации коленных суставов у собак применение ацетилсалициловой кислоты приводило к повышению степени выраженности дистрофического процесса в суставе: уменьшению содержания в матриксе и снижению биосинтеза протеогликанов хондроцитами в зонах повреждения хряща, увеличению экстрагируемости ГАГ. При этом метаболические нарушения биосинтеза протеогликанов сочетались с выраженным изменением биосинтеза коллагена. По всей вероятности, этот эффект был связан с повышенной проницаемостью ацетилсалициловой кислоты в дистрофически измененные хрящи. Если сравнить уровень биосинтеза ГАГ в натуженных и ненагруженных областях суставного хряща, то в большей степени ингибирование биосинтеза ГАГ в нормальных суставных хрящах было зафиксировано в ненагружаемых областях.
Данные наших исследований свидетельствуют о том, что в случае травматического повреждения суставного хряща и использования ацетилсалициловой кислоты отмечено значительное нарушение структурной организации хрящевой ткани и развитие в зоне дефекта коллагеноволокнистой ткани (рис. 3). Имеются и положительные данные, показывающие хондропротективное действие салицилатов в экспериментальных условиях после скарификации суставного хряща в коленном суставе кроликов [Simmons D. Р., Chrisman О. D., 1965]. Кроме того, доказано, что салицилаты не стимулировали катаболизма протеогликанов [Palmoski М. J., Brandt К., 1979]. Резюмируя сведения о применении салицилатов для фармакологической коррекции дистрофических процессов в суставах, необходимо отметить, что в настоящее время имеется больше пессимистических заключений, чем оптимистических данных об использовании этих препаратов.
Рис. 3. Суставной хрящ в условиях травматического повреждения и применения ацетилсалициловой кислоты:
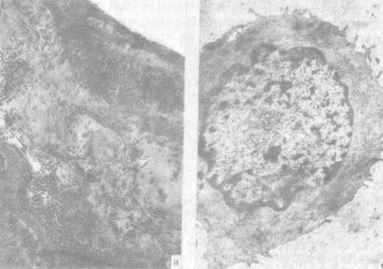
а) коллагеноволокнистая ткань в зоне дефекта, гематоксилин и эозин (МБИ-6, ув. 80);
б) хондроцит суставного хряща, скопления гликогена, единичные канальцы зндоплазматического ретикулума (контрастировано по Рейнольдсу, ЭМВ-100БР, ув. 13100)
Данные о подверженности суставного хряща действию индометацина приведены М. J. Palmoski, К. D. Brandt (1983). В эксперименте на культуре хрящевой ткани авторами были испытана доза индометацина, соответствующая реальной концентрации этого препарата в сыворотке крови у больных, которым проводили лечение (1,5 мг/мл). Доказано, что индометацин подавлял биосинтез ГАГ в ненагружаемых участках суставного хряща, а в нагружаемых зонах такого эффекта не было зарегистрировано. Повышение концентрации препарата не приводило к изменению характера его действия на различные участки хрящей, а предварительная обработка хрящей гиалуронидазой усиливала ингибирующее действие препарата. По всей видимости, факторы разрушительного действия салицилатов и индометацина на ненагружаемые участки суставного хряща могут быть объяснены накоплением этих веществ в хрящах, в то время как в нагружаемых областях суставного хряща за счет функционирования диффуфионно-нагрузочного механизма идет более ускоренный процесс вымывания этих препаратов из хрящевой ткани.
Э. Хаскисон (1986) приводит данные литературы о прогрессивном ухудшении рентгенологической картины поражения тазобедренного сустава при остеоартрозах в условиях назначения больным индометацина.
До настоящего времени в отношении хрящевой ткани в литературе отсутствуют данные о последствиях длительного применения НПВС. Представлены лишь результаты тестирования этих препаратов, как и других средств, используемых в терапии остеоартрозов и артритов, по влиянию на биосинтез (табл. 2).
Из приведенной в таблице группы препаратов пироксикама на структурную организацию суставных хрящей. Методами световой и электронной микроскопии доказано, что после 6 недель испытания препарата структура хондроцитов соответствовала таковой у интактных животных [Mohr W. е1 аl.,1984]. Синтез коллагена под влиянием пироксикама также не изменялся, однако биосинтез неколлагеновых белков был снижен [Mess Е. V., Herman J. Н., 1986].
Таблица 2.
Действие НПВС на биосинтез ГАГ в суставных хрящах [по данным Hess E., Herman I., 1986; в нашей модификации]
| Препарат | Авторы |
| Отсутствие эффекта | |
| Пироксикам | Herman J. H. et al., 1984 Mohr W.etal., 1984 |
| Сулиндак | Palmoski M. J., Brandt K. D., 1980 |
| Теноксикам | Bassleer C., Henrotin Y., Franchimont P., 1990 |
| Ингибирование биосинтеза | |
| Фенопрофен | Palmoski М. J., Brandt К. D., 1980 |
| Ибупрофен | Palmoski М. J. et al., 1980 McKenzie L. S. et al., 1976 |
| Индометацин | McKenzie L. S. et al., 1976 Pekel S. et al., 1980 Palmoski M. J. et al., 1980 Brohr H. J. et al., 1968 Mitrovic D. et al., 1984 |
| Фенилбутазон | Bostrom H. et al., 1964 Brohr H. J„ Kalbhen D. A., 1968 |
| Салицилаты | Bostrom H. et al., 1964 Mckenzie L. S. et al., 1976 Pekel S. et al., 1980 Palmoski M. J., Brandt K. D., 1979 Devries B. J. et al., 1985 |
| Толметин | Brandt K. D., Palmoski M. J., 1984 |
| Стимуляция биосинтеза | |
| Беноксапрофен | Palmoski M. J., Brandt K. D., 1983 |
| Сулиндак | Palmoski M. J., Brandt K. D., 1980 |
При изучении действия фенопрофена показано, что под его влиянием синтезируются мономеры протеогликанов, обладающие пониженной способностью взаимодействия с гиалуроновой кислотой [Palmoski М. J., Brandt К. D., 1980], что приводит к нарушениям в организации матрикса. Беноксапрофен, наряду с увеличением синтеза протеогликанов (до 135%) и биосинтеза белков (ДО 154%) [Palmoski М. J., Brandt К. D., 1980], не оказывал влияния на процессы сульфирования. Механизм действия беноксапрофена заключается в выраженном ингибировании липооксигеназы и умеренном — циклооксигеназы. Но, в целом, эффект его действия несколько отличался от действия других нестероидных противовоспалительных препаратов,
Одним из важных аспектов в оценке действия лекарственных препаратов на суставной хрящ является изучение состояния протеогликанов. Доказано, что в терапевтических концентрациях салицилата натрия, индометацин, ибупрофен, сулиндак стимулируют катаболические процессы протеогликанов.
В последние годы получен новый НПВП — теноксикам. Исследования, проведенные в культуре тканей хондроцитов, показали перспективность его применения. Так, даже при низких концентрациях (1, 3, 12, 48 мг/мл) не наблюдалось ингибирования включения 3Н-тимидина в ДНК, синтеза протеогликанов и коллагена 11 типа, а также повышения их выведения из матрикса в культуральную среду [Bassleer С., Henrotin Y., Franchimont Р., 1990].
При изучении влияния НПВС на моделях остеоартрозов у животных выявлены характерные особенности их проявления на систему суставного хряща. Так, лечение пирпрофеном после менискэктомии оказывало хондропротективное воздействие на суставной хрящ, снижая фибрилляцию хряща и замедляя потерю протеогликанов из матрикса. Кроме того, зафиксировано ингибирующее действие этого препарата на I краевые разрастания (остеофиты) в суставе [Wilhelmi G., 1978; I Colombo С. et al., 1983]. Аналогичное хондропротекторное действие оказывал диклофенак в условиях атрофии и дистрофии хряща.
В отличие от названных препаратов ацетилсалициловая I кислота усугубляла атрофические и дистрофические изменения в хрящевой ткани, усиливала экстрагируемость и выведение протеогликанов из хряща, что сопровождалось изменением биосинтетических процессов в хрящевой ткани [Palmoski М. J., Brandt К. D., 1982; Gay R. Е. et al., 1983].
Для объяснения воздействия НПВС на метаболизм |хрящей могут быть использованы сведения, полученные при Изучении патофизиологических механизмов изменения Метаболизма суставных тканей. В частности, данные о том, что ацетилсалициловая кислота и индометацин являются ингибиторами синтеза простат л андинеинтетазы.
Изучено в сравнительном аспекте влияние НПВС на биосинтез кадаболина клетками синовиальной мембраны при остеоартрозах. Доказано, что терапевтические концентрации пироксикама, салицилата натрия и индометацина по-разному влияют на этот процесс: пироксикам уменьшает биосинтез катаболина, в то время как индометацин и салицилат не оказывают действия.
В настоящее время доказано, что механизмы действия как стероидных, так и нестероидных противовоспалительных средств различаются точками приложения при купировании воспалительного процесса в суставах за счет ингибирования биосинтеза простагландинов (рис. 4).
Рис. 4. Точки приложения действия стероидных и нестероидных препаратов на биосинтез простагландинов
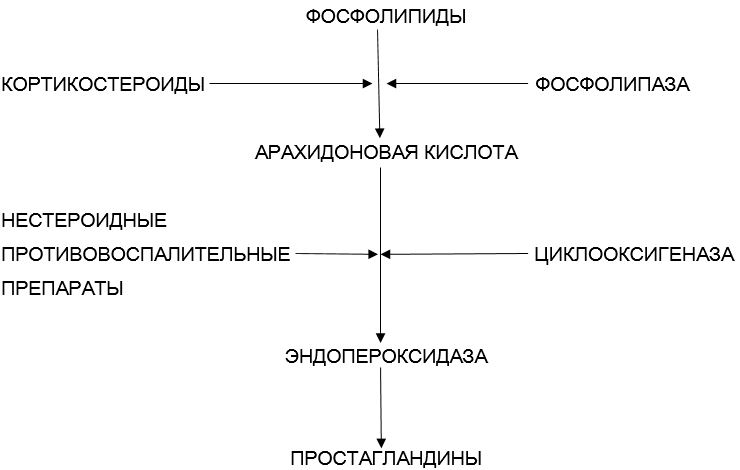
Так, основной механизм действуя НПВС — это независимое ингибирование циклооксигеназы, в то время как стероидные препараты блокируют действие фосфолипазы. Лишь единичные НПВС (ибупрофен, эффект на липооксигеназную систему.
Еще на одном аспекте действия нестероидных противовоспалительных средств необходимо остановиться. Доказано, что индометацин [Almasbakk К., Roysland M Р., 1977; Bitter М, А., Sieber J. М., 1985; Schmidt S. A. et al., 1988], диклофенак [Wahlstrom O. et al., 1989], ибупрофен [Elmstedt E. et aJ_ 1985] и напроксен [Gebur P. et al, 1991] предотвращают или снижают гетеротопическую оссификацию, развивающуюся у пациентов после артропластики или эндопротезирования тазобедренного сустава. Из перечисленных НГ1ВС наиболее выраженное действие с минимальным курсом лечения больных (всего 4 нед., по 250 мг препарата 3 раза в день, начиная с приема перед операцией) было зарегистрировано для напроксена. Остальные препараты необходимо было использовать в течение более длительного промежутка времени: ибупрофен — 3 мес., индометацин — б нед. Дополнительно к этому, при назначении больным индометацина с целью ингибирования процессов гетеротопической оссификации, врач должен помнить об их отрицательном действии на заживление переломов [Sudman Е. et al., 1979].
Влияния НПВС на суставные хрящи могут быть сведены к следующим:
- Воздействие на биосинтез ГАГ (стимулирование, ингибирование, отсутствие эффекта).
- Влияние на биосинтез коллагена (стимуляция, ингибирование, отсутствие эффекта).
- Активация или подавление катаболических процессов.
- Стимулирующее или ингибирующее влияние на процессы пролиферации клеток.
- Ингибирование гетеротопической оссификации после артропластики или эндопротезирования тазобедренного сустава.
При этом необходимо отметить, что воздействие лекарственных препаратов на биосинтез ГАГ и коллагена может происходить как на уровне ферментов, осуществляющих эти процессы, так и вследствие воздействия на процессы, регулирующие увеличение или уменьшение продуцирования предшественников биосинтеза. В то же время следует подчеркнуть, что эти макромолекулы играют существенную роль в организации матрикса хрящей и, соответственно, изменении биосинтеза ГАГ и коллагена, что сказывается на его прочностных свойствах.
Казалось бы, эти процессы должны находиться в тесной корреляции с пролиферацией клеток в суставном хряще. Однако этой закономерности не выявлено.
Таблица 3. Нестероидные противовоспалительные средства, рекомендуемые для применения при остеоартрозах, осложненных артритами
| Препараты | Дозы | Период полураспада, ч |
| Ацетилсалициловая кислота | 3 — 4 г в сутки | 2,5-9 |
| Бутадион | 150 мг 2 — 3 раза в сутки | — |
| Вольтарен | 25 мг 3 раза в сутки в течение 3 сут., затем дозу увеличивают до 100 — 150 мг в сутки | 6-12 |
| Ибупрофен | 200 мг 4 — 5 раз в сутки, либо 400 мг 3 раза в сутки | 2 |
| Индометацин | 25 — 50 мг 1 — 2 раза в сутки | 4-12 |
| Напроксен | 250 мг 2 раза в сутки, можно увеличить суточную дозу до 1000 мг | 12-15 |
| Пироксикам | 10 — 30 мг в сутки | 40-44 |
| Сулиндак | до 750 — 1000 мг 200 мг 2 раза в сутки | 7-12 |
| Фенилбутазон | 100 — 400 мг в сутки | 29 -175 |
Четко проявляется эффект воздействия СПВС и НПВС на синовиальную мембрану: в ней регистрируется уменьшение количества клеток в различных фазах воспалительного процесса. В связи с этим взаимоотношения между синовитами и деструкцией суставного хряща, на фоне вводимых лекарственных препаратов, нуждается в дальнейшем изучении. Рекомендуемые для введения дозы препаратов больным с остеоартрозами и период их полураспада представлены в табл. 3.3.
В клинике патологии суставов Харьковского научно-исследовательского института ортопедии и травматологии им. проф. М. И. Ситенко обобщен опыт применения НПВС [Кулиш Н. И. и соавт., 1991]. Авторы считают, что НПВС могут быть с успехом использованы при проведении предоперационной подготовки к хирургическим вмешательствам на тазобедренном суставе, а также в послеоперационном периоде с целью ранней реабилитации и улучшения функциональных результатов лечения.
Таким образом, данные литературы и собственные исследования авторов, предпринятые с целью выяснить влияние на суставной хрящ стероидных и нестероидных препаратов, свидетельствуют о том, что лечение ими деформирующих артрозов должно проводиться дифференцированно. Они могут применяться только как эпизод на различных фазах воспалительного процесса в суставе. Длительное их использование значительно ухудшает течение заболевания из-за ущерба, наносимого суставному хрящу: ингибированию обменных процессов в хондроцитах, влекущих за собой нарушение организации матрикса, что значительно снижает способность хрящей к нагрузкам. В условиях применения этих препаратов неадекватные нагрузки приводят к дополнительной травматизации суставного хряща. В связи с этим при лечении артрозов, сочетающихся с артритами, СПВС и НПВС оптимальным является вариант комплексного использования этих препаратов с препаратами-хондропротекторами. Для лечения остеоартрозов при латентных формах наиболее приемлемы препараты-хондропротекторы.
Хондропротекторные средства
Термин „препараты-хондропротекторы” был введен в 1960 году при оценке характера действия румалона и артепарона, препаратов, целенаправленно влияющих на метаболизм хрящевых тканей, стимулирующих в хондроцитах биосинтетические процессы и повышающих устойчивость хрящей к действию ферментов катаболизма. Позднее этот термин был применен к мукартрину.
Артепарон, румалон, мукартрин — препараты животного происхождения. Биохимический состав этих препаратов зависит от условий технологии, но фармакологическая активность их обусловлена ГАГ, среди которых: хондроитинсульфаты, кератансульфаты, дерматансульфаты, гиалуронаты и гепарин.
Учитывая, что основным структурным компонентом хондропротекторных средств принято считать аминосахар — глюкозамин, остановимся на его физиологическом значении.
Несмотря на широкое распространение глюкозмина в биологических системах, его роль в большинстве случаев не ясна, не систематизированы данные о его физиологическом значении в организме. Однако в последние годы появилась информация о высокой фармакологической (противоартрозной) активности лекарственных средств, созданных на основе глюкозамина [Senin Р. et al, 1963]. В данном разделе показано физиологическое значение глюкозамина, что может послужить предпосылкой для расширения его фармакодинамики как лекарственного препарата, а также оптимизировать поиск фармакологически активных веществ среди его производных.
Глюкозамин — наиболее часто встречающийся в природе аминосахар. Он содержится в полисахаридах (хитин, гепарин) [Панов В. И., Овсепян А. М., 1979; Страйер Л., 1984; Уайт А. и др. 1981], гликопротеинах [Dressler F., 1985], гликозаминогликанах [Marsh J., 1985], входит в состав биологических мембран и соединительной ткани, но редко встречается в свободной форме [Balazs Е. A. et al., 1965].
Углеводы как компоненты живой ткани давно привлекают внимание различных исследователей. Если ранее их рассматривали исключителен© как энергетический материал, то в настоящее время установлено, что многие из них выполняют прежде всего защитную функцию [Заварзина Г. А., 1975]. Действие их в организме животного и человека изучено на молекулярном (ингибирование и активация ферментов), клеточном (резистентность мембран), органном (предохранение желудочно-кишечного тракта) уровнях. При введении в организм многие полисахариды повышают его устойчивость к действию различных патогенных факторов [Маслаков Д. А., Эйсмонт К. А., 1974].
Метаболизм глюкозамина может осуществляться двумя путями: фосфорилированием и ацетилированием. Высокие концентрации глюкозы, имеющиеся в печени, эффективно ингибируют фосфорилирование глюкозамина [McGarrachan F. F., Matey F., 1962], поэтому основной путь метаболизма глюкозамина — через ацетилирование, очевидно, с участием неспецифической ариламиноацетилнзы, за которым уже следует фосфорилирование.
Установлено, что глюкозамин 14С, вводимый интактным крысам, включается в гликопротеины печени [Shetlar М. R. et аl., 1959]. Использование аминосахаров может быть удобным способом получения гликопротеинов высокой специфической активности. Однако высокая значимость утилизации печенью свободного М-ацетилглюкозамина проблематична. Кроме того, утилизация печенью глюкозамина путем фосфорилирования ингибируется при наличии глюкозы обычной концентрации.
Поскольку глюкозамин в печени не превращавшей в гексозы и гексозфосфаты и слабо превращается в гликоген, утверждение, что при введении большого количества глюкозамина увеличивается содержание гликогена в печени кроликов, следует рассматривать с осторожностью [Balazs Е. А., 1965].
Содержание и физиологическая роль аминосахаров в почках изучены недостаточно. Имеются данные [Miyakawa N., 1968], что в почках находятся некоторые ферменты, участвующие в синтезе и взаимопревращении глюкозамина. Особого внимания почки заслуживают потому, что их жизненно важные элементы (базальные мембраны) по своей Природе являются гликопротеидами. Этот орган страдает при амилоидозе, мукополисахаридозе, диабете, сопровождающихся изменением содержания аминосахаров. Кроме того, в патогенезе различных почечных заболеваний и, прежде всего, при гломерулонефрите наблюдается изменение базальной Почечной мембраны [Тареев Е. М., 1983].
С целью изучения развития толерантности глюкозамину в эксперименте его вводили в высокой концентрации. Отмечено, что глюкозамин появляется в моче у всех опытных животных и наблюдаемых людей, однако скорость его выведения несколько снижена в случаях почечных заболеваний и развившегося карциноматоза [Weiden S., 1958]. Клиренс глюкозамина в опытах на собаках соответствует скорости почечного кровотока и гломерулярной фильтрации и не наблюдается его тубулярная реабсорбция [Carter М. К., Peters L., 1958]. При введении глюкозамина кроликам происходит его повышенная экскреция, а также увеличение содержания следующих Ингредиентов мочи: общего азота, аммиака, мочевины и молочной кислоты.
Таким образом, глюкозамин может способствовать усилению детоксической функции почек, приобретая важное значение при хронической почечной недостаточности, вызванной различной нефрогенной патологией.
Нефрэктомия у крыс оказывает незначительное влияние на скорость исчезновения глюкоэамина из сыворотки крови после его внутривенного введения, что еще раз подчеркивает высокую способность экзогенного глюкозамина метаболизироваться в организме.
Интерес представляют данные изучения высокомолекулярного гликопротеина, содержащего N-ацетил-глюкозамин и названного фибронектином [Белоусов Ю. Б. и соавт., 1987]. С помощью метода иммунофлюоресценции показано, что фибронектин в организме человека находится в базальных мембранах, рыхлой соединительной ткани, стенках синусоидов печени, а также на поверхности макрофагов. Основная функция его аминосахарного компонента, вероятно — связывание различных субстратов (фибрина, коллагена, бактериальных тел), подлежащих затем удалению посредством ретикулоэндотелиальной системы [Saba Т. М., Jaffe Е., 1980],
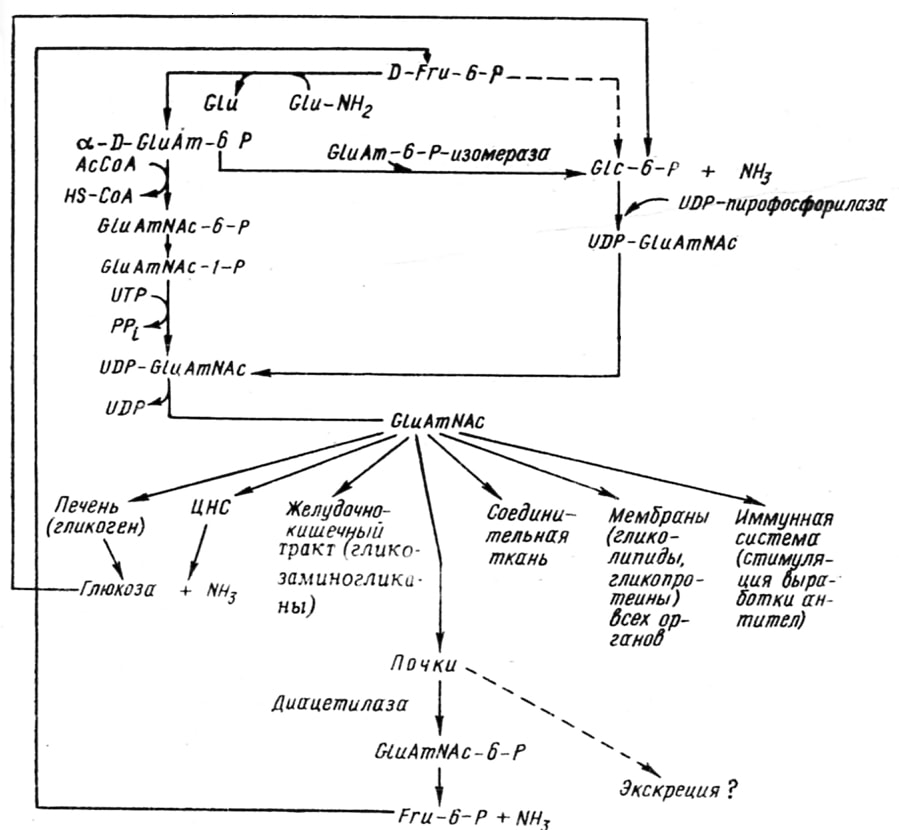
Анализ данных литературы позволил нам доставить схему синтеза и обмена глюкозамина в организме (рис. 3.5). Судя по этим данным, глюкозамин и его производные могут обладать противовоспалительным, антигипоксическим, гепатозащитным, дезинтоксикационным и другими фармакологическими свойствами, что и было нами доказано в доследующих исследованиях [Зупанец И. А. и соавт., 1987; 1988; 1990; Сальникова С. И. и соавт., 1990; Яковлева Л. В., 1988].
Артепарон
Артепарон — это этерифицировзнные сульфогруппой гликозаминогликаны, содержащие уроновые кислоты и гексозамины, экстрагированные из легких и трахеальных хрящей быков. Оценка препарата проводилась в клиниках более 20 стран мира. Артепарон хорошо зарекомендовал себя при лечении остеоартрозов крупных и мелких суставов, при патологии позвоночника (спондилозах и спдндилоартрозах), при хондропатиях надколенника, после операций по породу удаления мениска [Eylau О., 1963; Ishikawa К. et al., 1982; Eckenberger Н. Р., 1983; Hurme М., Forsskahl В., 1984; Hoffmann Н. F., 1985]. Действие препарата изучено при двух способах введения: внутримышечном и внутрисуставном. Схемы, рекомендованные для лечения больных, обоснованы и представлены в рекламных проспектах фирмы. Курс лечения включает 15 инъекций (внутримышечное введение) и 10 инъекций (внутрисуставное введение) (табл. 3.4). При необходимости лечение может быть повторно через 3 мес. Артепарон дает хорошие результаты при консервативной терапии повреждений менисков (10-15 инъекций на курс с частотой от 2 до 3 инъекций в неделю). В том случае, если артепарон используется после оперативных вмешательств по удалению мениска коленного сустава, лечение необходимо начинать не раньше, чем через 14 дней после операции.
Рис. 5. Схема синтеза и обмена глюкозамина (——> возможный путь обмена). Ас-ацетил, СоА-кофермент А, Glc-глюкоза, Glu-глутаминовая кислота, GluAmNac-N-ацетилглюкозамин, Fru-фруктоза, РР-пирофосфат, Glu-NН2-глутамин [Зупанец И. А. и соавт., 1990]
Имеются данные о более высокой эффективности лечения гонартроза артепароном после предварительной лекарственной терапии нестероидными противовоспалительными средствами и анальгетиками, а также методами физиотерапии (УВЧ, СВЧ, электростимуляция и грязевые ванны) [Eckenberger Н. Р., 1983].
Интерес к препарату не угасает и по сей день. На симпозиуме с международным участием в г. Харькове (1991) были представлены материалы по применению артепарона в ортопедии, в частности при лечении диспластических коксартрозов [Кулиш Н. И. и соавт., 1991], при поясничных спондилоартрозах [Радченко В. А. и соавт., 1991]. в лечении хондромаляции надколенника [Сименач Б. И., Нестеренко С. А., Пустовойт Б. А., 1991]. Авторы отметили высокую эффективность препаратов в лечении названных заболеваний и представили оптимальные схемы лечения больных. Так, Н. И. Кулиш и соавт. (1991) считают рациональным лечение артепароном через 6 мес. после хирургической коррекции нарушенных биомеханических взаимоотношений в суставе (реконструкция надвертлужной области по А. А. Коржу, реконструкция проксимального отдела бедренной кости), а также при кистозных изменениях в головке и крыше после костной аутопластики. Положительные результаты зафиксированы и при консервативном лечении больных.
В. А. Радченко и соавт. (1991) показали, что при лечении поясничных спондилоартрозов артепарон клинически более эффективен при внутрисуставном введении.
Б. И. Сименач, С. А. Нестеренко, Б. А. Пустовойт (1991) считают необходимым более дифференцированный подход к лечению артепароном хондрсмаляции надколенника травматического и диспластического генеза. В частности, при диспластической патологии авторы рекомендуют применять артепарон лишь после коррегирующих оперативных вмешательств.
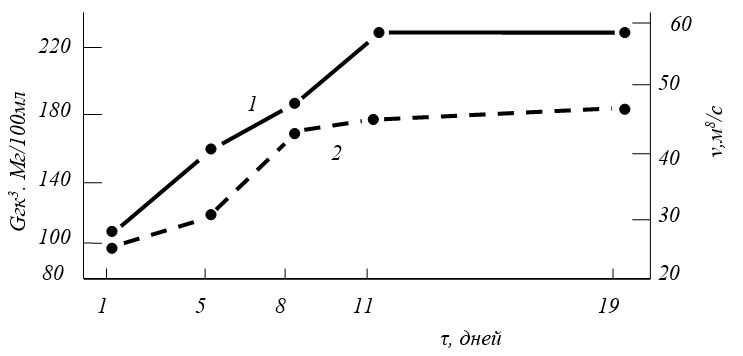
Доказано, что синовиальная мембрана вне зависимости от способа введения препарата выполняет функции, регулирующие его поступление или отток из синовиальной жидкости. Так, при обоих способах введения зафиксировано попадание артепарона в сыворотку крови, высокий уровень препарата в которой сохранялся до 12 ч, а также накопление его в синовиальной жидкости [Panse Р., Meske-Brand S., Muller W., 1984]. При изучении влияния артепарона на состав и свойства синовиальной жидкости было показано, что через 24-48 ч после его введения вязкость синовиальной жидкости была повышена за счет увеличения в ней концентрации гиалуроновой кислоты (рис. 3.6) [Momburg М., 1976; Verbruggen G., Veys Е. М., 1977].
Рис. 6. Влияние артепарона на концентрацию гиалуроновой кислоты (Сг-К мг/100 мл и вязкость синовиальной жидкости-(м2/с) [Momburg М. et аl, 1976].
При этом гиалуроновая кислота имела высокую степень полимеризации, что свидетельствовало о ее новообразовании синовиоцитами. Этот эффект наблюдался длительное время после введения препарата и выведения его из синовиальной жидкости, что указывает, по мнению авторов [Verbruggen G., Veys E. М., 1977], на аккумуляцию препарата в межклеточном веществе синовия. Если сравнить уровень биосинтеза в синовиоцитах гиалуроновой кислоты, гепарина и хондроитинсульфатов, то биосинтез гиалуроновой кислоты во много раз превышает остальные (рис. 3.7).
Кроме того, в синовиальной жидкости увеличивалось содержание лактата с 9 до 49 % и снижалось содержание глюкозы от 27 до 72% [Verbruggen G., Veys F. М., 1977], что было связано с увеличением утилизации глюкозы и накоплением молочной кислоты (рис. 3.8).
Доказано, что суставные хрящи способны аккумулировать артепарон из синовиальной жидкости, при этом максимальное содержание его в хрящах отмечено через 48 ч после введения (рис. 3.9), а фармакологическая активность препарата проявлялась в течение 4 дней. При использовании радиоактивных образцов гепариноида было показано, что препарат легко проникает как в хондроциты, так и в синовиоциты [Enislidis А. С., 1972]. Максимальная концентрация препарата в этих клетках прослеживается через 3 ч после 1 введения. Несмотря на утилизацию его хондроцитами и синовиоцитами, даже через 2 нед в следовых количествах он; обнаруживается в этих клетках. Фармакологический эффект артепарона заключается в ингибировании ферментов, способствующих деградации матрикса.
Рис. 7. Сравнительный анализ биосинтеза синовиоцитами гепарина, хондроитинсульфата и гиалуроновой кислоты под влиянием артепарона
Рис. 8. Изменение (в %) содержания лактата и глюкозы в синовиальной жидкости после инъекции сульфатированных ГАГ [по Verbrugen G., Veys M., 1977]
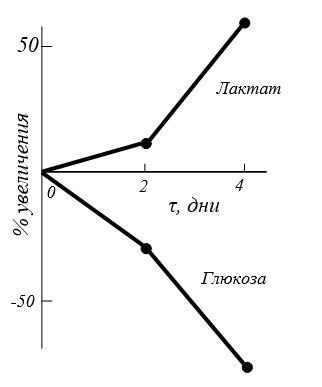
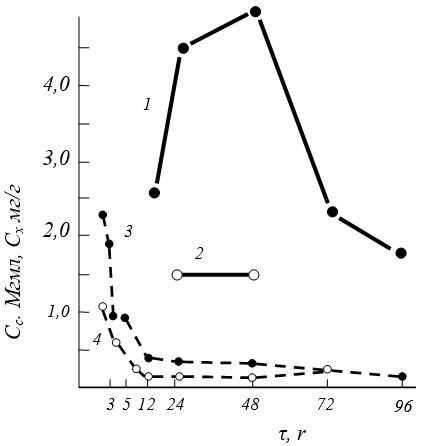
Рис. 9. Концентрация артепарона в сыворотке (Сс) и хряще (Сх) у пациентов с остеоартрозом после внутримышечного введения 50 или 125 мг препарата, меченного 3Н: 1-Сх=125 мг/г; 2-Сх=50 мг/г; 3-Сс = 125 мг/нл; 4-Сс=50 мг/нл
В целом пути хондропротекторного воздействия препарата артепарон представлены на схеме (рис. 3.10).
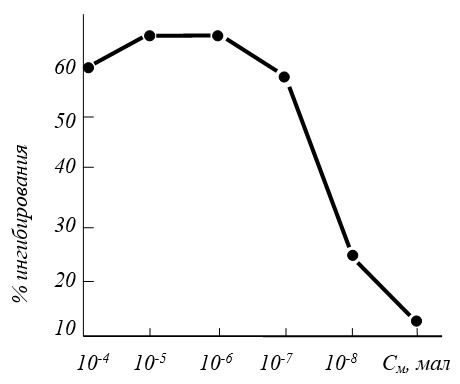
Kruse D. et al. [1976] доказали, что артепарон в концентрации от КМ до КМ ммоль ингибирует до 59% активность нейтральных протеаз. Однако с уменьшением концентрации | препарата эффективность его действия снижается (рис. 3.11).
На модели папаиновой артропатии коленного сустава показано, что нарушения в суставах сопровождаются повышением уровня протеогликаназы и коллагеназы. Лечение животных артепароном способствовало редукции ферментативной активности и повышению биосинтеза ДНК [Skrivankova В. et al., 1991].
Рис. 10. Пути хондропротективного воздействия препарата артепарон [проспект фирмы „Luitpold-werk”]
![Пути хондропротективного воздействия препарата артепарон [проспект фирмы „Luitpold-werk”]](https://www.vethospital.ru/wp-content/uploads/2019/06/Ris-10-optimized.jpg)
Биологическое действие препарата артепарон проявляется в стимулировании биосинтетических процессов в хондроцитах и синовиоцитах. На модели деформирующего артроза, индуцированного у животных путем введения дексаметазона, доказано [Annefeld М., 1984], что лечение артепароном способствовало увеличению в хондроцитах объема гранулярного эндоплазматического ретикулума (на 29%) и комплекса/
Рис. 11. Ингибирование активности нейтральных протеаз артепароном [по Kruze D. et al., 1976]. Концентрация артепарона 10-7 ммоль соответствует 1 мкг/мл
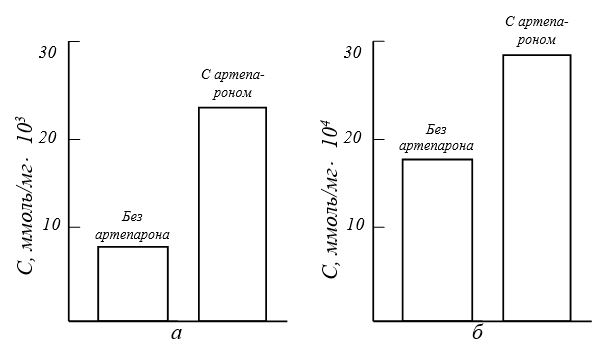
Гольджи (на 69%). Эти данные указывают на усиление биосинтетической и секреторной активности хондроцитов. При этом полисахариды и белки, синтезируемые клетками, путем пиноцитоза выводятся в межклеточное пространство, где принимают участие в формировании матрикса. Также методами биохимического анализа было доказано увеличение содержания протеогликанов в остеоартрозном суставном хряще человека при лечении артепароном [Adam М. et al., 1980] (рис. 12).
Кроме того, установлено увеличение объема и количества лизосом в хондропитах, что свидетельствует об интенсификации расщепления питательных веществ, поступающих в клетку путем фагоцитоза. Лечение артепароном сопровождается уменьшением в хондроцитах объема, занимаемого липидными включениями и элементами цитоскелета: микрофиламентами и микротрубочками.
Препарат оказывал выраженное хондропротекторное действие на структуру суставного хряща и снижал на 40% количество деструктивно измененных клеток по сравнению с контролем.
В экспериментах in vitro было доказано, что артепарон снижает биосинтез коллагена в хондроцитах, но стимулирует биосинтез неколлагеновых белков в клетках по сравнению сконтролем [Mark К., 1982]. Имеются данные [Menninger Н., Mohr W., 1981] об увеличении эластических свойств суставного хряща в условиях экспериментов, целенаправленно вызывающих снижение его эластичности (рис. 14).
Рис. 12. Увеличение концентрации протеогликанов (а) и коллагена (б) в суставном хряще человека при лечении артепароном [по Adam М. et аl., 1980]
В литературе представлены данные лишь единичных исследований, посвященных изучению иммунологических показателей в условиях введения в организм артепарона. Доказано, что артепарон проявляет антикомплементарную активность [Biffoni М., Paroli Е., 1991].
Лечение препаратом артепарон оказывает положительное влияние на иммунологические и метаболические показатели обменных процессов в организме. Ю. П. Делевским и Л. С. Кононенко (1991) обобщены данные по изучению иммунного статуса больных идиопатическим и диспластическим коксартрозом при лечении артепароном. После применения препарата у больных выявлена тенденция к нормализации Т-лимфоцитов (общих, активных и теофиллинрезистентных), IgA и Ig М, снижение индекса спонтанной миграции лейкоцитов, что является показателем иммунореактивности. Кроме того, авторами было отмечено возрастание количества нормэргических реакций в процессе ингибирования миграции лейкоцитов с хрящевым и бактериальным (стафилококк, стрептококк) антигенами и снижение уровня аутоантител (по показателям иммуноферментного анализа) к гликолипидным и белковым фракциям из хрящевой ткани, что свидетельствует о снижении аутоиммунных проявлений.
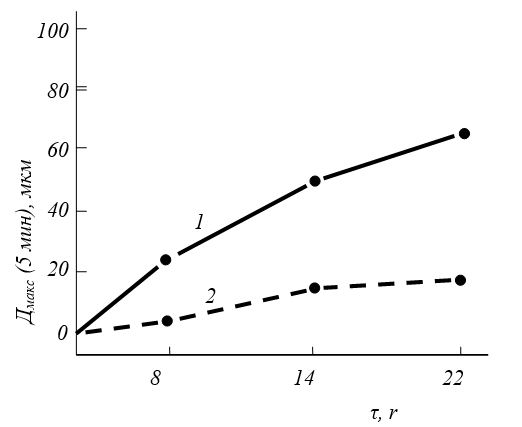
Рис. 14. Деформация суставного хряща: 1- после инкубации с эластазой без лечения; 2- при лечении артепароном [Menninger Н„ Mohr W., 1981]. Дмакс — максимальное увеличение деформации; t -время инкубации
А. Ю. Пащук, С. В. Либенсон, Ф. С. Леонтьева (1991) провели оценку некоторых показателей углеводно-белкового обмена в организме больных остеохондрозом, гонартрозом и коксартрозом, путем определения концентрации в сыворотке крови хондроитинсульфатов, гликозаминогликанов, фибронектина гликопротеидов и сиаловых кислот. У 58 — 61% больных — авторами выявлено повышение концентрации сиаловых кислот и гликопротеидов на фоне сниженного содержания фибронектина. К концу лечебного периода зафиксировано обратное соотношение этих макромолекул. Авторы полагают, что концентрация фибронектина в сыворотке крови, как и содержание хондроитинсульфатов и сиаловых кислот, могут рассматриваться как коррелят состояния суставного хряща при патологии и при лечении остеоартрозов.
При анализе научной литературы, касающейся аспектов применения артепарона, мы не обнаружили данных о специфике реакции тканей суставов на препарат в условиях метаболических нарушений в организме. Нами были проведены исследования по изучению регенерации хрящевой ткани суставов в условиях экспериментального моделирования диабета. Первая серия экспериментов (контроль, моделирование аллоксанового диабета у крыс + травматическое повреждение суставного хряща) служила контролем ко второй серии, в которой проведено лечение артепароном травматического повреждения суставов, протекающее на фоне аллоксанового диабета. Различий в структурно-метаболических процессах в первой и второй сериях экспериментов в зоне дефекта и в прилежащем к ней суставном хряще не было обнаружено. Эти данные свидетельствуют о необходимости более углубленного подхода к назначению артепарона пациентам с патологическими или физиологическими сдвигами метаболических процессов в организме.
С 1972 года параллельно с лабораторными и клиническими испытаниями проводились разработки по усовершенствованию состава артепарона. Составной компонент артепарона — сульфатированные формы ГАГ с добавками флуфеналиковой кислоты, этиленгликольмоносалициловой кислоты и базовой эмульсии изготовлены в виде мази (препарат мобилизин), которая рекомендована для лечения воспалительных заболеваний в суставах при ревматизме и остеоартрозах, спондилоартрозах и т. д.
Другим препаратом, усовершенствованным на базе артепарона, является мобилат. Он модифицирован за счет введения в его состав гидрокортизона ацетата и обладает выраженным противовоспалительным действием.
Румалон
В 1960 году G. Astaldi, Е. Strossli и С. Rinaldi сообщили о биологической активности препарата румалон (Rumalon или Arumalon, производство фирмы Robapharm). Румалон представляет собой экстракт из хрящевой ткани и красного костного мозга молодых животных и включает ГАГ-пептидные комплексы.
Первые работы, в которых была проведена оценка действия румалона, показали, что в культуре ткани из эмбрионального хряща стимулируется хондрогенез, увеличивается включение 35 S04 и повышается синтез хондроитинсульфатов (Astaldi G. et al., 1960; Weigel W., Jasisnki B., 1962).
К настоящему времени действие румалона на обменные процессы в хрящевых и соединительных тканях изучено в различных тест-системах in vitro и in vivo.
Данные исследований, накопленные к 1990 году, представлены в табл. 5.
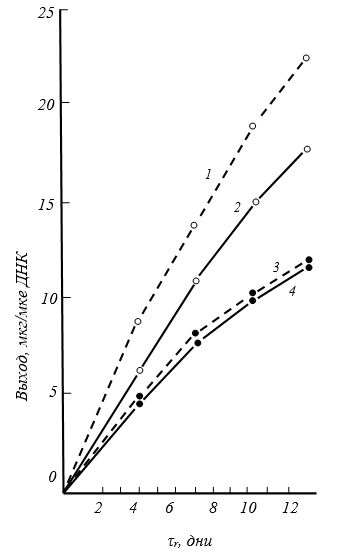
В более поздних исследованиях, проведенных в культуре хондроцитов, было подтверждено и дополнено, что румалон в зависимости от использованной дозы и сроков культивирования, может стимулировать деление клеток, биосинтез протеогликанов и коллагена II типа [Bassleer С., Henrotch J., Franchimont Р., 1990] (рис. 15).
Таб. 5. Фармакологические свойства румалона, выявленные в экспериментах in vitro (по Wagenhauser F. J., 1984)

Рис. 15. Влияние румалона на биосинтез протеогликанов (на МКГ ДНК). По оси абсцисс выделение протеогликанов в хрящах (по содержанию в культуральной среде) [Bassleer С., Henrotin У., Franchimont Р., 1990]
Протекторное влияние румалона было доказано и в экспериментах на животных в условиях моделирования дистрофического повреждения суставов: применение дексаметазона [Annefeld V., 1984] и повреждение надколенника [Mazieres В. et al., 1984]. В первом случае на основе морфометрического анализа (табл. 6.) автор сделала заключение, что под влиянием румалона значительно увеличивается объем эндоплазматического ретикулума, комплекса Гольджи, лизосом. Эти данные свидетельствуют о повышении в клетках биосинтетических процессов, нарушенных вследствие повреждения дексаметазоном.
Во втором случае [Mazieres В. et al., 1984] после лечения румалоном (внутримышечные инъекции 3 раза в неделю, по 0,5 мл/кг массы животных) выявлено ингибирование артроза, развивающегося в суставе вследствие травмирования и смещения надколенника. При этом в контрольной группе животных артротические изменения в суставе были выраженными. Данные морфологического исследования (табл. 7) убедительно свидетельствуют о перспективности лечебно-профилактического использования румалона при начальных стадиях остеоартрозов.
Таблица 6.
Морфологические показатели ультраструктурной организации хондроцитов после моделирования дистрофического процесса и лечения румалоном [по Annefeld М., Raiss R., 1984 ].
![Морфологические показатели ультраструктурной организации хондроцитов после моделирования дистрофического процесса и лечения румалоном [по Annefeld М., Raiss R., 1984 ]](https://www.vethospital.ru/wp-content/uploads/2019/06/tabl-6-optimized.jpg)
Таблица 7.
Морфологические исследования состояния суставного хряща при лечении румалоном [по Mazieres В. et ай, 1984]
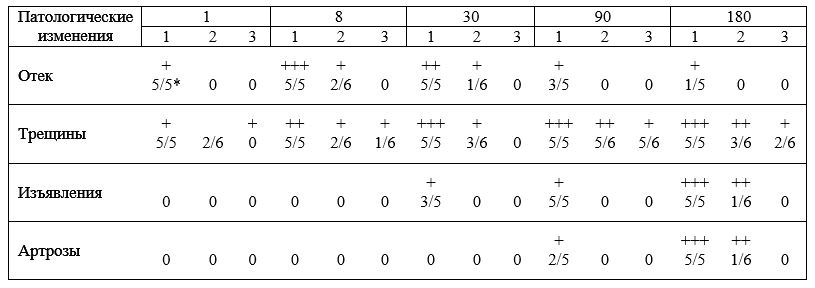
1 — травма; 2 — травма и лечение; 3 — лечение без травмы (противоположная травмированной конечность из группы 2); + — легкая форма; + + — форма средней тяжести; +++ — тяжелая форма; * — показатель числителя — количество животных с проявившимся признаком, показатель знаменателя — общее количество животных
Применение препарата в клинике также дало положительные результаты при лечении коксартроза, гонартроза, полиартрозов, остеохондроза и спондилеза. В результате лечения в •большинстве случаев наблюдалась положительная динамика: уменьшение или исчезновение болей в суставах при пальпации и движении. Однако на ночные боли в суставах румалон оказывал слабое влияние [Гуобис Г., Талетене И., 1974]. При оценке действия препарата более чем на 300 больных установлено, что у 70% пациентов уменьшаются боли, замедляется прогрессирование артрозных изменений в суставах [Павленко Т. М., 1969]. Автор рекомендует применение румалона в ранних и недалеко зашедших стадиях болезни, когда обнаруживаются лишь слабовыраженные признаки разрушения хряща. Рекомендуемая доза введения, после которой наблюдали эффект — 1 мл препарата. Всего необходимо на курс лечения 25 внутримышечных инъекций. Рентгенологическое обследование больных остеоартрозами дало основание после длительного применения румалона сделать заключение о статистически достоверном снижении прогрессирования заболевания [Rejholec V., Kralova .М.,1975; 1979; Rejholec V., 1981; Wagenhauser F. J., 1984].
Мукартрин
Сходными с артепароном и румалоном свойствами обладает и препарат мукартрин (Mucarthrin, производство „Фармахим”, Болгария). Препарат представляет собой сернокислый эфир гликозаминогликанов. Лабораторные и клинические испытания препарата свидетельствуют о его хондропротек- торных свойствах [Матев М. и др. 1977].
При лечении больных мукартрином обнаружено повышение минерализации костной ткани, восстановление структурной организации костных трабекул субхондральной кости, уменьшение площади, занимаемой кистами. Отмечено, что оптимальное воздействие препарата наступает через 3-4 мес. При этом объем движения в суставах у больных артрозами значительно увеличивается [Пащук А. Ю., Мезенцева Р. М., 1971].
Препарат не оказывает токсического воздействия на организм. Так, после 30 дней лечения мукартрином остаются неизменными лабораторные показатели СОЭ, картины крови, протромбинового индекса, уровня фосфатаз и т. д. Повышается количество лимфоцитов, фибриногена, альбумина, гамма-глобулина, мочевины, сиаловых кислот, то есть данные лабораторных исследований больных отражают изменения белкового обмена, на который непосредственно направлено действие лекарственного препарата.
При развитии остеоартрозов, как указывалось выше, одним из составляющих этого заболевания остаются элементы острого экссудативного воспаления, пусковым звеном которого является деструкция суставного хряща, как следствие развития порочного круга данной патологии. В то же время клинические и экспериментальные данные об антиэкссудативных свойствах корректоров метаболизма соединительной
ткани — румалона, артепарона и мукартрина, в литературе отсутствуют. В представленных ниже данных исследований авторов дан сравнительный анализ антиэкссудативньи свойств вышеуказанных препаратов. Опыты проведены на модели каррагенинового отека (каррагенин фирмы „Sigma”, США) у мышей [Яковлева Л. В., Зупанец И. А., 1987]. Румалон мукартрин и артепарон вводили в широком диапазоне доз oi 5 до 100 мг/кг в сутки внутримышечно за 1 ч до индукции воспаления. Такая постановка опыта позволила рассчитать эффективные дозы (ДЕ) препаратов по антиэкссудативном) действию [Хаджай Я. И., 1985]. Результаты исследования приведены в табл. 3.8.
Как видно из таблицы, румалон и мукартрин обладают идентичной фармакологической активностью 20% в дозах 42 и 46 мг/кг соответственно, артепарон — 30% в дозе 54 мг/кг.
В механизме антиэкссудативного действия мукартрина артепарона и румалона, по всей видимости, имеет значение стабилизация лизосомйых мембран, так как в их структуре содержится 2-амино-2-дезокси-0-глюкоза (глюкозамин), у которой обнаружен указанный механизм противовоспалительного действия (Зупанец И. А., 1988, 1991).
Таким образом, в фармакодинамике данных препаратов имеет определенное значение их антиэкссудативное действие, что должно учитываться при использовании в клинике.
Фармакологические свойства и некоторые аспекты клинического применения глюкозаминов
Аналогами существующих хондропротекторных средств следует считать глюкозамин, который может использоваться в медицине в двух формах: глюкозамин сульфат (артепарон, ДОНА — 200S) и глюкозамин гидрохлорид (N-ацетилглюкозамин).
Фармакологическому и клиническому изучению глюкоза мина сульфата посвящено ряд работ. Впервые глюкозамин сульфат был синтезирован Вгеиег в 1889 году и промышленный метод запатентован в ряде стран: Англия, США, Швейцария. Поскольку невозможно исключить некоторые неблагоприятные свойства этого соединения, а именно, гигроскопичность и легкость окисления его аминогруппы, которые усложняют использование вещества в эксперименте и клинике, создание препаратов на основе глюкозамина сульфате испытывает серьезные трудности. Тем не менее создан ряд препаратов на этой основе [Senin Р., Makovec F., Rovati L., 1983 следующего состава.
Таблица 8. Сравнительный анализ антиэкссудативной активности румалона, мукартрина и артепарона на модели каррагенинового отека у мышей.
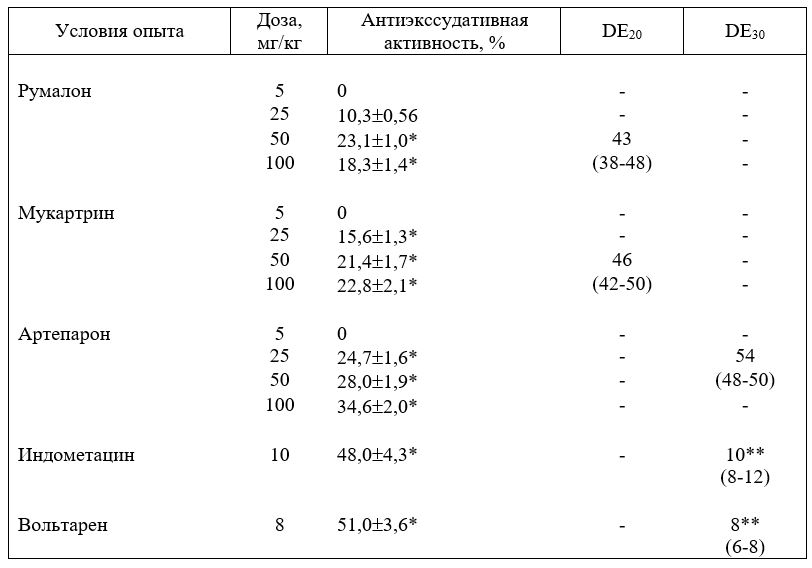
Таблица 8. * -Р < 0,05; ** — DE50
Лекарственная форма — флаконы, содержащие сублимированный состав.

Несмотря на некоторые различия в физико-химических характеристиках и технологических составах, фармакологические свойства глюкозамина сульфата и названных препаратов идентичны.
В опытах in vitro на изолированных эмбриональных фибробластах, которые способны в соответствующих условиях дифференцироваться в различные виды соединительной ткани, в том числе и костнохрящевую, показана способность глюкозамина сульфата стимулировать биосинтез ГАГ (по включению радиоактивной метки Na2S04).
Табл. 9. и 10 свидетельствуют о выраженной стимуляции биосинтеза как свободных, так и тканевых ГАГ, что может явиться одним из возможных механизмов хондропротекторных свойств данного аминосахара. На аналогичный эффект действия имеются указания и в А. с. № 1428383 (СССР).
Противовоспалительные свойства глюкозамина сульфата исследованы Senin Р. et al. [1983] на модели „ватной” гранулемы у крыс в дозах 300-600 мг/кг. Установлена антипролиферативная активность, составляющая 40,9 — 54,1%. Вызывает интерес тот факт, что, несмотря на усиление в клетках биосинтеза белка и ГАГ, глюкозамин сульфат подавляет пролиферацию клеток.
Одним из важных факторов, ограничивающих широкое использование стероидных и нестероидных противовоспалительных средств в фармакотерапии остеоартрозов, является их высокая токсичность. В связи с этим данные по токсикологической характеристике D-глюкозамина сульфата служат необходимым дополнением в понимании его эффективности и широты терапевтического действия (табл. 3.11).
Анализируя результаты (табл. 11), следует отметить: 1) отсутствие видовой специфичности; 2) практическую безвредность Д-глюкозамина сульфата. Установленные закономерности можно объяснить тем, что данный аминосахар является естественным метаболитом организма животных и человека.
Результаты клинического применения глюкозамина сульфата на примере препарата ДОНА-200Б свидетельствуют о его высокой эффективности. Хороших и очень хороших результатов удалось добиться при лечении гонартрозов — в 87%, коксартрозов — 83%, хондропатий надколенника — 86%, спондилозов — в 82% случаев. При назначении ДОНА-200Б не требовалось применения анальгетиков.
Учитывая, что в биологических объектах из всех аминосахаров преобладает N-ацетилглюкозамин, S. Orlich [1987] предложил в клиническую практику для лечения остеоартрозов хондропротекторный препарат на его основе. Отмечено, что N-ацетил-глюкозамин обладает лучшей переносимостью, чем глюкозамин сульфат, и более низкой токсичностью. Суточная доза данного препарата составила 100 — 5000 мг [Orlioh S., 1987].
В последнее время нами совместно со специалистами Пятигорского фармацевтического института — доцентами В. А. Компанцевым, И. И. Самокиш и другими – разработана технология производства и оценки фармакологических свойств нового хондропротекторного препарата глюкозамина гидрохлорида (таблетки, раствор для инъекций). Преимущества данного препарата перед известными хондропротекторными средствами состоят в том, что полностью обеспечена сырьевая и материально-техническая база для получения субстанции глюкозамина гидрохлорида из хитина криля и креветок, а также более совершенная и экономичная технология.
Таблица 9. Стимуляция выработки свободных ГАГ в культуре фибробластов, полученных из эмбрионов мышей (по накоплению 35S) под влиянием глюкозамина сульфата [Senln P.etal 1983]
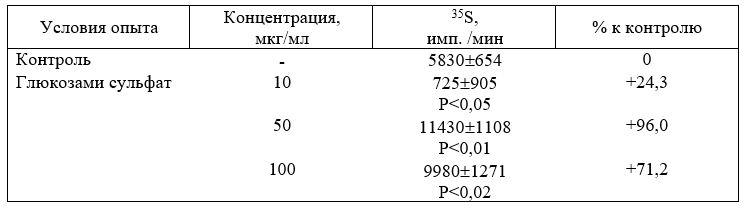
Р — достоверность различий по отношению к контролю.
Таблица 10. Стимуляция выработки тканевых ГАГ в культуре фибробластов мышей, полученных из эмбрионов (по включению S) под влиянием глюкозамина сульфата [Senin Р. et aL, 1983]
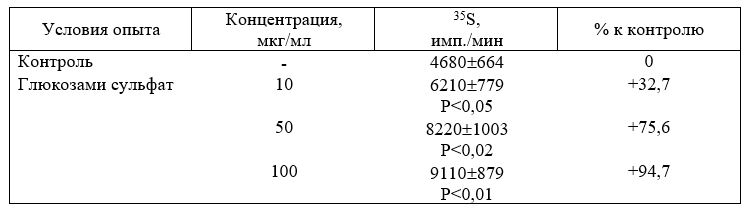
Р — достоверность различий по отношению к контролю.
Таблица 11. Острая токсичность Д-глюкозамина сульфата и его производного ДОНА R200- S
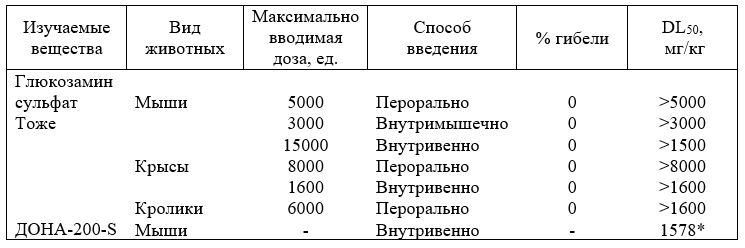
*DL50 рассчитано относительно Д-глюкозамина.
Глюкозамин гидрохлорид обладает широким спектром фармакологической активности. Его антиэкссудативные свойства не уступают существующим НПВС: ацетилсалициловой кислоте, бутадиону и другим наиболее широко используемым препаратам. Так, в экспериментальных условиях доказано, что DE50 глюкозамина гидрохлорида при моделировании формалинового отека у мышей составляет 50 мг/кг. При каррагениновом отеке удалось обнаружить DE2o=50 мг/кг [Зупанец И. А., 1988]. Антиэкссудативная активность глюкозамина гидрохлорида на моделях острого асептического воспаления, вызванного различными флогогенными агентами, представлена в табл. 3.12.
Как видно из таблицы, в механизме антиэкссудативного действия глюкозамина основная роль принадлежит его влиянию на биологически активные амины (гистамин), стабилизацию мембран, антипротеазное действие. Отсутствует влияние на серотонин, гиалуронидазу и ПГЕ2- Выраженная антиэкссудативная активность глюкозамина гидрохлорида подтверждена нами и в сериях опытов на модели токсического отека легких у крыс [Зупанец И. А., 1988], который вызывали введением 6% раствора хлористого аммония из расчета 400 мг/кг [Триняк В. Г., 1968] (табл. 13).
Обнаруженные антипролиферативные свойства у глюкозамина сульфата послужили основанием для изучения взаимосвязи антиальтеративного и антипролиферативного эффектов Д-глюкозамина гидрохлорида в сравнении с НПВС-индометацином, вольтареном и пироксикамом [Яковлева Л. В., Зупанец И. А., Дроговоз С. М., 1988].
Индометацин, пироксикам и Д-глюкозамин статистически достоверно угнетали образование грануляционной ткани в очаге воспаления на 31 — 54% (табл. 14). Но высокоэффективным действием при альтеративной фазе воспаления обладал только Д-глюкозамин. Вольтарен проявлял незначительную как антиальтеративную, так и антипролиферативную активность. Индометацин и пироксикам интенсивно подавляли образование грануляционной ткани и не способствовали заживлению ран. Д-глюкозамин был высокоактивен как при альтеративной, так и при пролиферативной фазах воспалительного процесса. Сравнение результатов, полученных на двух моделях воспаления, свидетельствует о том, что между антипролиферативной и антиальтеративной активностью индометацина, пироксикама и вольтарена существует обратная симбатная зависимость: чем более выраженные антипролиферативная активность, тем меньше (или отсутствует) антиальтеративная активность. Такую корреляцию между антиальтеративной и антипролиферативной активностью изученных НПВС можно объяснить их способностью угнетать биосинтез коллагена, что положительно проявляется при пролиферативных изменениях и отрицательно — при альтеративных. Доказательством этого предположения могут служить следующие данные литературы. Известно, что механизм антиэкссудативного действия изученных препаратов в большей степени связан с угнетением синтеза простагландинов. [Usardi М. М. et al„ 1981].
Таблица 12. Антиэкссудативная активность глюкозамина гидрохлорида на моделях острого асептического воспаления у крыс, вызванного различными флогогенными агентами [Зупанец И. А. и соавт., 1988]
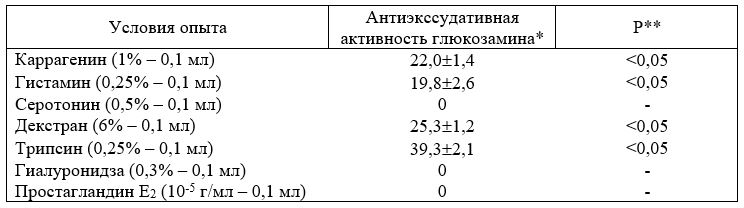 Глюкозамин вводили в дозе 50 мг/кг, * * значения Р рассчитаны по отношению к контрольным (нелеченным) животным.
Глюкозамин вводили в дозе 50 мг/кг, * * значения Р рассчитаны по отношению к контрольным (нелеченным) животным.
Таблица 13. Влияние глюкозамина на течение отека легких у крыс
Таблица 14. Антипролиферативная активность вольтарена, индометацина, пироксикама, Д-глюкозамина (М ±m ).  *Р < 0,05 в сравнении с контролем.
*Р < 0,05 в сравнении с контролем.
Этот механизм лежит в основе наиболее тяжелого их побочного эффекта — ульцерогенного действия. Неизбирательное угнетение НПВС синтеза простагландинов, в том числе регулирующих микроциркуляцию слизистой оболочки желудка, приводит к нарушению процессов регенерации и развитию язв желудка. Молекулярный механизм угнетения синтеза простагландинов противовоспалительными средствами связан с ингибированием образования цАМФ в клетках, уменьшением энергообразования и угнетением биосинтетической функции клеток. В отличие от индометацина, вольтарена и пироксикама у D-глюкозамина сочетаются антипролиферативный и антиальтеративный эффекты. Механизм противовоспалительного действия D-глюкозамина, по-видимому, не связан с угнетением синтеза коллагена, а в большей мере зависит от его резорбции, чем и объясняется антипролиферативная активность. Такое предположение коррелирует с результатами применения D-глюкозамина при лечении кожно-мышечных ран (табл. 15). Отсутствие ульцерогенного действия у D-глюкозамина [Зупанец И. А. и соавт., 1991] свидетельствует о том, что он практически не подавляет биосинтез простагландинов и не вызывает изменений в биосинтезе коллагена. В связи с этим процессы регенерации при альтерации тканей не ингибируются, а обнаруживаемый эффект стимуляции репаративной регенерации, вероятно, объясняется возможным антипротеолитическим действием препарата. Кроме того, D-глюкозамин обладает способностью индуцировать образование факторов, усиливающих процессы регенерации: лимфокинов, кейлонов и других факторов, стимулирующих формообразовательные процессы в соединительной ткани.
Таблица 15. Антипролиферативная активность вольтарена, индометацина, пироксикама, D-глюкозамина (М ±m ).
 Активность — уменьшение площади раны, % по отношению к контролю; v — скорость, f заживления ран; * -> Р < 0,05 по отношению к контрольным (нелеченым животным).
Активность — уменьшение площади раны, % по отношению к контролю; v — скорость, f заживления ран; * -> Р < 0,05 по отношению к контрольным (нелеченым животным).
После изучения противовоспалительных свойств D-глюкозамина гидрохлорида была изучена его хондропротекторная активность.
Изучение действия глюкозамина и румалона проводили на модели посттравматического артроза у крыс [Зупанец И. А., Дедух Н. В., 1989] в четырех сериях экспериментов.
1. Контрольные животные. 2. Румалон (в/м) — 50 мг/кг. 3. Глюкозамин (в/м) — 50 мг/кг. 4. Глюкозамин (перорально) — 50 мг/кг.
Нарушение структурной организации суставного хряща и субхондральной кости, а также выраженность репаративного процесса в различных участках головки учитывалась в баллах по специально разработанной системе на 30 сут после травмы и лечения препаратами. Принимали во внимание состояние хондроцитов и матрикса суставного хряща, а также костной ткани (см. Приложение).
Макроскопически у нелеченых животных в головке бедренной кости четко определялось место дефекта в виде небольшого углубления (2-3 мм), занимающего 1/6 часть хрящевого покрытия. Вблизи дефекта хрящ был тусклый и имел желтоватый оттенок. На остальном протяжении он сохранял белизну и был глянцевым.
Микроскопически на препаратах головки бедренной кости выявлялся дефект в хрящевом покрытии, который распространялся до субхондрального отдела головки (рис. 3.16). Базофильная линия вблизи дефекта нарушена, костные трабекулы имели неровные края и были истончены, а на поверхности некоторых из них отсутствовали остеоциты. Межтрабекулярные пространства ниже зоны дефекта выполнены клеточно-волокнистой тканью. На остальной территории субхондрального отдела головки изменения в костных трабекулах были выражены в меньшей степени, а межтрабекулярные пространства заполнены красным костным мозгом.
Края дефекта со стороны суставного хряща неровные. Толщина суставного хряща в этой области снижена (иногда до 1/2) по сравнению с остальным массивом хрящевого покрытия. Бесклеточные участки выявляются как в этой области, так и на остальной территории хрящевого покрытия. Иногда в гиалиновом хряще вблизи края дефекта определялись поля гиперплазии крупных хондроцитов с гипохромными ядрами и базофильной цитоплазмой. Обращало на себя внимание наличие трещин и щелей как вблизи зоны дефекта, так и на расстоянии от него. Отмечены участки разрушения хряща вплоть до базофильной линии и подхрящевой костной пластинки. В таких участках цитоархитектоника была резко нарушена и большей частью в них обнаруживались мелкие хондроциты с пикнотичными ядрами. Основное вещество хрящевой ткани имело выраженную базофильную окраску.
Рис. 16. Клеточный состав зоны дефекта головки бедренной кости. Нелеченые животные. 30 дней после нанесения дефекта:
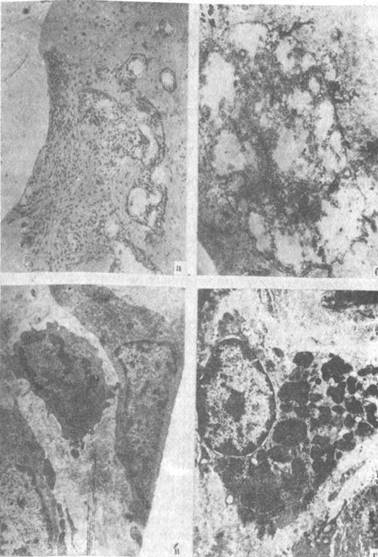
а) зона выполнена сетчато-волокнистой тканью, краевые отделы суставного хряща без хондроцитов, гематоксилин и эозин (МБИ-6, ув.80); б) некроз клетки в поверхностной зоне суставного хряща (контрастировано по Рейнольдсу, ЭМВ-100БР, ув. 10000); в) клетки фибробластического ряда из зоны дефекта (контрастировано по Рейнольдсу, ЭМВ- ЮОБР.ув. 11200); г) Зона дефекта. Тучная клетка (контрастировано по Рейнольдсу, ЭМВ-ЮОБР, ув. 12300).
Зона дефекта во всех случаях, в основном на 2/3 ее глубины, была представлена слоями коллагеноволокнистой ткани различной толщины и клеточности. Коллагеновые волокна были плотно упакованы, между ними определялось большое количество клеток фибробластического ряда с крупными овальными гиперхромными ядрами и базофильной цитоплазмой.
Репаративный процесс, протекающий в головке бедренной кости после нанесения травмы, может быть охарактеризован как „неполная” регенерация за счет формирования в зоне дефекта коллагеноволокнистой ткани, а на массиве суставного хряща — изогенных групп клеток. При использовании полуколичественных методов оценки процесс регенерации охарактеризован как слабовыраженный (8,93 балла, табл. 3.18).
При анализе макромолекулярной организации хрящевого матрикса (ГАГ и коллагена) установлено проявление слабой метахромазии и рефракции ГАГ в участках хряща, не содержащих клеток, в основном в местах, прилежащих к зоне дефекта. В более отдаленных от дефекта областях суставного хряща с сохраненной цитоархитектоникой после окраски толуидиновым синим четко выявлялась не только метахромазия, но и рефракция, достигающая достаточно высоких значений. В зоне дефекта рефракция ГАГ была несколько ниже (табл. 3.16). Рефракция коллагена определялась на всех участках суставного хряща, однако она также была неоднородной, в частности, в бесклеточных участках и на остальной территории хряща повышалась в 1,5 и 1,7 раза (табл. 3.17), что свидетельствует о компенсаторных проявлениях в функционировании хондроцитов.
Изучение головки бедренной кости после нанесения стандартного дефекта, проникающего до субхондральной кости, позволило заключить, что травматическое повреждение вызывает у крыс развитие дистрофических и деструктивных изменений в суставном покрытии головки. Комплекс описанных выше изменений характерен для остеоартрозов. Данная модель может быть использована при экспериментальной апробации препаратов хондропротективного действия.
Таб. 16. Рефракция ГАГ в различных участках суставного хряща крыс под влиянием глзокозамина, НМ
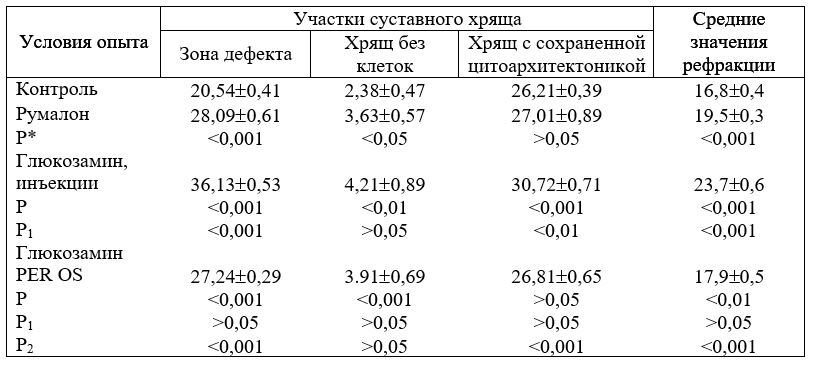
Р — достоверность различий по отношению к контролю;
P1 — достоверность различий по сравнению с серией животных, получавших румалон;
Р2 — достоверность различий по сравнению с серией животных; получавших глюкозамин в инъекциях.
Таб. 17. Значения рефракции (НМ) коллагена в различных участках суставного хряща крысы под влиянием глюкозамина
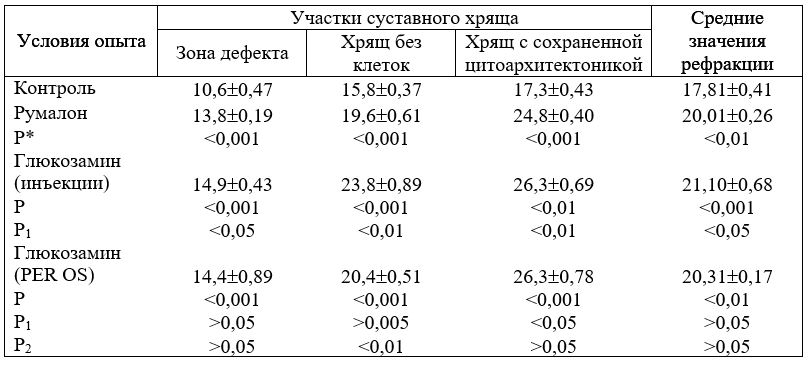
* — обозначения Р аналогичны табл. 16.
При применении румалона в качестве препарата сравнения макроскопически, как и в предыдущей серии, место дефекта обнаруживалось в виде небольшого углубления, заполненного белесоватым содержимым. На остальной территории суставной хрящ сохранял блеск.
Микроскопически в большинстве случаев дефект был выполнен волокнистым хрящом с крупными вытянутыми клетками, ядра которых содержали гиперхромный хроматин (рис. 3.17). Цитоплазма клеток четко контурировалась и была ба зофильной. Коллагеноволокнистая хрящевая ткань выявлялась и в межтрабекулярных пространствах субхондральной кости. Вокруг дефекта в суставном хряще обнаруживались поля без клеток. В отдельных случаях базофильная линия была разрушена и поля новообразованной костной ткани непосредственно прилежали к некальцифицированному хрящу. Зачастую в таких участках клетки поверхностной зоны были некротизированы. Нарушалась рефракция ГАГ и коллагена.
Рис. 17. Клеточный состав зоны дефекта головки бедренной кости. 30 дней после нанесения дефекта.
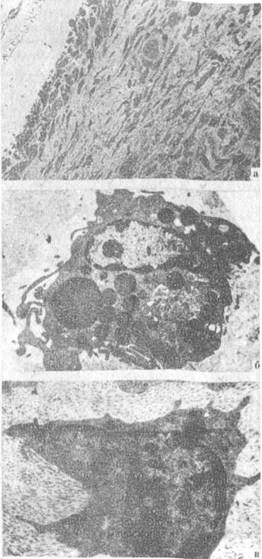
Лечение румалоном:
а) клетки фибробластического ряда, сосуды. Полутонкие срезы (окраска толуидиновым синим, МБИ-б, ув.80); б) тучная клетка (контрастировано по Рейнольдсу, ЭМВ-ЮОБР, ув. 18000); в) префибробласты, коллагеновые волокна (контрастировано по Рейнольдсу, ЭМВ-ЮОБР, ув. 18600).
Обобщая полуденные данные о структурной организации хрящевого покрытия, а также учитывая данные по ориентационной упорядоченности коллагена и ГАГ, принимая во внимание состояние субхондральной костной ткани, можно заключить, что при лечении румалоном в головке бедренной кости репаративные процессы преобладали над деструктивными. Используя балльную систему оценки, развивающийся репаративный процесс в головке бедренной кости в данной серии можно охарактеризовать как средневыраженный (14 баллов).
При применении глюкозамина (внутримышечные инъекции) макроскопически в головках бедренной кости место дефекта определялось в виде белесоватого пятна на поверхности головки. На остальной территории суставной хрящ был блестящий с голубоватым оттенком.
Микроскопически в препаратах головки бедренной кости выявлялось место дефекта, заполненное в основном гиалиновым хрящом, лишь в краевых отделах перемежающимся с волокнистым (рис. 3.18). Краевая поверхность дефекта, открывающаяся в полость сустава, в подавляющем большинстве случаев была ровная, образованная рядом густо расположенных клеток. Лишь в 14% случаев на этих участках обнаруживались небольшие углубления, выполненные волокнистой хрящевой тканью. Большая часть хрящевого покрытия, прилежащая к зоне дефекта и на расстоянии от него, сохраняла характерную для интактного суставного хряща цитоархитектонику, лишь вблизи дефекта, обнаруживались очаги гиперплазии хондроцитов. Непосредственно к зоне дефекта прилежали костные трабекулы с явлениями реактивной перестройки. Они были утолщены и содержали на поверхности большое количество остеобластов и крупных остеоцитов. Межтрабекулярные пространства были заполнены в основном красным костным мозгом. Развитие хондроидной ткани было отмечено в отдельных межтрабекулярных пространствах, прилежащих к зоне дефекта, а также на расстоянии от нее — в глубоких субхондральных отделах головки бедренной кости. Хондроциты в таких участках были крупные с гиперхромными ядрами и большой базофильной цитоплазмой. Клетки располагаются хаотично, но в краевых отделах дефекта расположение хондроцитов и особенности их структурной организации соответствовали этим показателям для гиалинового хряща.
Рис. 18. Клеточный состав зоны дефекта головки бедренной кости. 30 дней после нанесения дефекта.
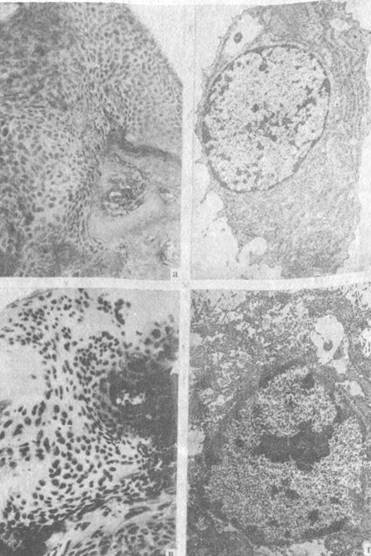
Лечение глюкозамином:
а) хондробласты и единичные фибробласты в зоне дефекта, гематоксилин и эозин
(МБИ-6, ув. 80); 6) хондробласты (контрастировало по Рейнольдсу, ЭМВ-100БР, ув. 11300); в) фрагмент суставного хряща, прилежащий к зоне дефекта, гиперплазия хондроцитов, гематоксилин и эозин (МБИ-6, ув. 80); г) хондроцит из зоны дефекта, ядро с большим количеством ядерных пор, содержащее преимущественно эухроматин; скопления гликогена в цитоплазме, секреторные пузырьки (контрастировано по Рейнольдсу, ЭМВ-100БР, ув. 26000).
В поляризованном свете отмечена яркая метахромазия и выраженная рефракция ГАГ в участках новообразованной гиалиновой хрящевой ткани, которая превышала значения таковой контроля в 1,7 раза (табл. 17). На остальных участках хряща рефракция ГАГ была также выше контрольных значений: вблизи зоны дефекта — в 1,7 раза, а в зоне хряща с неизмененной цитоархитектоникой — в 1,4 раза.
Рефракция коллагена обнаруживалась на всем протяжении хрящевого покрытия, но в отличие от ГАГ наиболее низкая ее величина зафиксирована в зоне дефекта, а в участках, прилежащих к ней, превышала показатели контроля в 1,4 раза (табл. 18). Самая высокая рефракция обнаруживалась в отделах суставного хряща с сохраненной цитоархитектоникой (в 1,5 раза выше чем в контроле). Средние суммарные значения рефракции коллагена также были несколько выше (в 1,2 раза) по сравнению со значениями, определенными для нелеченых животных. При сравнении показателя рефракции ГАГ и коллагена с результатами, полученными при лечении румалоном, выявлено, что средние значения рефракции ГАГ превышали значения рефракции во второй серии в 1,2 раза, а значения рефракции коллагена были сравнимы.
Таким образом, при внутримышечном введении глюкозамина (после моделирования остеоартроза) установлено, что на 30 сух в головке бедренной кости преобладали репаративные процессы — разрастание гиалиновой хрящевой ткани в зоне дефекта, гиперплазия хондроцитов вблизи этой зоны, активация остеогенеза в участках, прилежащих к дефекту со стороны субхондральной кости, а также более высокие, чем в контроле, значения рефракции ГАГ и коллагена.
При балльной системе оценки состояния головки бедренной кости развивающийся репаративный процесс, а также хондропротекторное действие глюкозамина может быть охарактеризовано как выраженное (19 баллов).
Таб. 18. Оценка репаративного и хондропротекторного действия глюкозамина гидрохлорида в головке бедренной кости крыс после моделирования посттравматического остеоартроза (баллы)
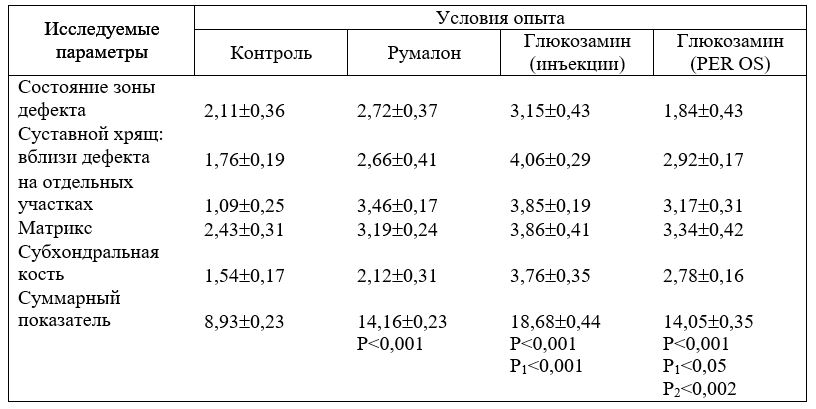
Обозначения: Р — сравнительный анализ данных по отношению к контролю; P1 — сравнительный анализ данных по отношению к румалону; Р2 — сравнительный анализ данных по отношению к глюкозамину (инъекции).
При изучении глюкозамина в таблетированной форме выявлено, что по направленности процессов, протекающих в головке бедренной кости, оно сходно с действием глюкозамина в виде инъекций.
Однако сравнение рефракции и количественной оценки изменений в головке показало, что эффект, наблюдаемый при таблетированной форме значительно ниже действия глюкозамина в инъекциях, но приближается к эффекту, оказываемому румалоном. Достаточно выраженное (до 60%) преобладание сохраненных участков суставного хряща в головке бедренной кости над дистрофическими свидетельствует о высоких хондропротекторных свойствах данного препарата.
Итак, анализ результатов фармакологического изучения глюкозамина в таблетках и инъекционной лекарственной форме в сравнении с румалоном, показал, что лечебно-профилактическое действие вышеуказанных препаратов проявляется в активизации метаболизма суставного хряща, стимуляции репаративных процессов в хрящевой и костной тканях, то есть оказывает хондропротекторное влияние и стимулирует репаративные процессы. Однако степень выраженности лечебного эффекта препаратов различная. Так, румалон способствовал стимуляции регенерации хряща, однако формирующийся регенерат (на месте дефекта) состоял из коллагеноволокнистой ткани, т. е. имеющий место — репаративный процесс может быть охарактеризован как „неполная” регенерация суставного хряща. Но, в целом, румалон оказывает стимулирующее воздействие на метаболические процессы в суставном хряще и антидегенеративное влияние на катаболизм протеогликанов и коллагена. По характеру воздействия на ткани сустава близок к румалону препарат глюкозамина в таблетированной форме. Более выраженным эффектом обладает глюкозамин в инъекционной лекарственной форме.
По степени эффективности лечебно-профилактического воздействия на посттравматические остеоартрозы препараты могут быть распределены следующим образом:
Румалон (14,16 балла) — 100%
Глюкозамин (инъекции) (18,68 балла) — 131,9%
Глюкозамин (per os) (14,05 балла) — 99,3%
В последние годы имеются разработки, в которых показано, что сочетание глюкозамина с другими веществами обеспечивает наиболее оптимальный эффект противоартрозного действия.
На основе глюкозамина в США разработан комбинированный противоартрозный препарат [патент № 4647453]. В его состав входят: 1-5 частей аскорбиновой кислоты, 2-10 частей костной муки (как источника солей кальция), тирозина или фенилаланина (как предшественника или стимулятора образования эпинефрина) и глюкозамина в качестве противовоспалительного средства.
По всей вероятности, в настоящее время имеются данные лишь о некоторых свойствах и проявлениях действия глюкозамина. Более детальный анализ — предмет исследования недалекого будущего, но уже и на сегодняшний день накоплены интересные данные о способности глюкозамина потенцировать и усиливать противовоспалительные свойства нестероидных противовоспалительных средств. Детальное описание этого феномена представлено в главе 4.
Другие препараты
В настоящее время большое внимание уделяется исследованию репаративного действия препаратов моно-, олиго- и полисахаридной природы. И, хотя разрабатывающиеся препараты еще не приобрели лекарственную форму, а существуют в виде заявок и патентов на лечебное средство, доказано, что эффект препарата возрастает при увеличении степени сульфирования полисахаридов [заявка ЕВП № 0230023]. Действие средств проявляется при числе сульфогрупп более трех на одну манозу и значительно возрастает при использовании персульфатов. Наибольшую репаративную активность проявляет октасульфат сахарозы.
В настоящее время имеются данные об использовании в лечении остеоартрозов производных несульфатированных форм ГАГ, в частности, гиалуроната натрия. Экспериментальные разработки в условиях моделирования остеоартрозов (модель Pond-Nuki) подтвердили высокую эффективность этого препарата. Так, если в группе нелеченых животных на фоне рассечения крестовидной связки движения в нестабильном суставе приводили к развитию остеоартрозов с целым комплексом характерных изменений (снижению метахромазии в матриксе, уменьшению плотности хондроцитов на единицу площади, эрозии хрящевого покрытия), а в случаях формирования паннуса и его срастания с хрящевой тканью деструкции поверхностных отделов суставного хряща, то в условиях введения в сустав гиалуроната натрия не отмечачалось прогрессирования артротических изменений [Schiovinato A. et al., 1989]. Методами биохимического анализа доказано, что при моделировании остеоартроза еженедельное введение 7 мг препарата в сустав собак приводило к снижению экстрагируемости протеогликанов из матрикса хрящей (по сравнению с нелеченой группой животных) [Abatangelo G. et al., 1989]. Эффективность препарата зависела от начала лечения. Показано, что в группе животных, которым лечение начинали проводить в первую неделю после травмы и в течение 6 нед. деформирующий артроз в суставе не развивался. Если лечение начинали с 7 нед. и заканчивали к 13 нед., то отмечено ингибирование развития дистрофического процесса. Следовательно, наилучший эффект достигается при более раннем применении препарата.
Авторы выдвигают следующую гипотезу, объясняющую механизм хондропротекторного влияния на суставной хрящ. Известно, что при остеоартрозах хондроциты утрачивают способность поддерживать функцию внеклеточного матрикса. Благодаря участию гиалуронатов в ряде биологических процессов — морфогенезе, активации клеток, во взаимодействии с ферментами — эта функция может быть восстановлена.
На основе гиалуроната натрия создан препарат ARTZ, хорошо зарекомендовавший себя в экспериментальных исследованиях и клинике.
Имеется точка зрения и экспериментальные доказательства, что использование производных хитина перспективно при лечении артрозов. С одной стороны, препараты хитина, характеризующиеся небольшой молекулярной массой, практически нетоксичны [Плиско Е. А., Нудьга А. А., Данилов С. Н., 1977], с другой стороны, они способны регулировать активность многих ферментов [Chevrel В., 1982; Gawett Е. R., 1982; McCarthy С. F., 1983]. Структурным компонентом молекул хитина является глюкозамин. Более детально его фармакологические свойства и некоторые аспекты клинического применения, имеющие отношение к данной теме, рассмотрены в предыдущем разделе 3.3.5.
Но, прежде чем перейти к следующей главе, остановимся на разработках, которые представляют альтернативный вариант или принципиально новое технологическое решение в создании препаратов с хондропротективными свойствами. Ключ к пониманию проблемы создания высокоэффективных лекарственных средств любой фармакотерапевтической группы, в том числе и хондропротекторов, по мнению Г. Г. Шитова и соавт. (1989), находится в разгадке механизмов
регуляции метаболизма, и в связи с этим в основу технологического подхода должны быть заложены следующие принципы биохимии, биотехнологии и фармации.
1. Препарат должен иметь белковую природу, так как все биологические процессы, в том числе и метаболические, регулируются в основном с помощью белков.
2. Необходимо обеспечить максимально выраженную видовую совместимость исходного сырья, то есть, чем ближе природа белкового вещества к организму человека, тем выше вероятность достижения цели.
3. Эффект от медикаментозной коррекции метаболизма может быть достигнут лишь в том случае, если будет обеспечена стабильность действующего вещества (веществ) как вне организма, так и в системе. Это одно из весьма важных биохимических и технологических условий, так как даже если будет установлено строение какого-либо естественного регулятора и осуществлен его синтез или выделение, то введение в организм неизбежно приведет к дезактивации.
В качестве объекта для получения препарата авторами выбрана плацента, а технологическим приемом явилось получение естественных биополимеров с высокой степенью окисления. Предварительные исследования позволили сделать заключение о выраженности хондропротекторного действия полученных продуктов окислительно-гидролитической модификации.
Список литературы:
1. А. с. № 14283883 СССР МКИ4 А 61К 35/78. Способы получения вещества, обладающего регенерирующим, цитопротективным и ингибирующим действием /Мамчур Ф. К., Банин С. А., Гризодуб А. М. (СССР). Заявл. 14.06.87. Опубл. 04.06.88. // Изобретения стран мира. — 1989. — 2. — С. 6.
2. Беленький М. С. Опыт применения румалона при лечении первичных дегенеративно-дистрофических заболеваний суставов позвоночных // Ревматизм. — К.: Здоров’я, 1975. -Вып. 8. — С. 50 — 52.
3. Белоусов Ю. Б., Шишкин А. В., Панченко Е. П. Фибронектин и его клиническое значение //Кардиология. — 1987. — № 1. — С. 100 — 103.
4. Гуобис Г., Талетене И. О патогенезе дистрофических поражений суставов и эффективности лечения румалоном //Вопросы ревматизма. — 1974. — № 4.-С. 35- 39.
5. Дедух Н. В. Морфологические аспекты воздействия гормонов на суставной хрящ в онтогенезе: Дис. д-ра биол. наук. — М., 1988. — 360 с.
6. Дедух Н. В., Панков Е. Я. Гормональная регуляция процессов развития и роста хрящей //Успехи соврем, биологии. — 1988. — № 6. — С. 454 — 469.
7. ЕПВ № 0230023 МКИ * А 61К 31/70. Лекарственные препараты для заживления ран /Michaeli D. (США). Заявл. 19.12.86. Опубл. 29.07.87// Изобретения стран мира. — 1988. — № 4. — С. 13.
8. Заварзина Г. А. Изучение химического состава липопротеидов поверхностно-активного вещества легких-сурфактанта: Автореф. дис. … канд. биол. наук. — Симферополь, 1975. — 22 с.
9. Заявка N° 3602670 (ФРГ) МКИ4А 61 31/70. Verwendung von N-Ace- tylglucosamin zur Werwandter Erkzankungen/Speck Orlich. Заявл. 29. 01.86. — Опубл. 30.07.87.
10.Зупанец И. А., Яковлева Л. В., Дроговоз С. M. и др. Ненаркотические аналгетики среди производных N-R-оксанилоил-О-глюкозамина //Фармакология и токсикология. — 1987. — Т.50, № 4. — С. 36 — 38.
11. Зупанец И. А. Поиск противовоспалительных и анальгизирующих средств в ряду производных (М-Я-оксамоил-О-глюкозамина: Дис. … канд. мед^наук. — X., 1988. — 179 с.
12. Зупанец И. А., Дроговоз С. М., Яковлева Л. В. Физиологическое значение глюкозамина //Физиол. журн. — 1990. — Т. 36, № 2 — С. 115 — 120.
13. Зупанец И. А., Яковлева Л. В., Белецкая О. В. Фармакодинамические особенности глюкозамина в патогенетической терапии отека легких (Экспериментальное исследование) //Фармакодинамика современных лекарственных средств, применяемых в клинической анестезиологии и реаниматологии: Сб. науч. тр. — X., 1988. — С. 79 — 82.
14. Зупанец И. А., Бездетко Н. В., Реякиман И. З., Семенов А. Н. Перспективы использования аминосахаров при язвенных поражениях желудка// Гастроэнтерология. — 1991. — Вып. 23. — С. 50 — 53.
15. Зупанец И. А., Дроговоз С. М„ Бездетко Н. В., Дедух Н. В. Эксперимент тельное моделирование посттравматического остеоартроза тазобедренного сустава у крыс //Оценка фармакологической активности химических соединений: принципы и подходы: Тез. докл. Всесоюз. науч. конф. — М., 1989.-Т. 2.-С. 132.
16. Клиническая нефрология /Под. ред. АМН СССР Е. М. Тареева. — М.: Медицина, 1983. — 416 с.
17. Кудрин А. Н., Ряженое В. В. Руководство к лабораторным занятиям по фармакологии. — М.: Медицина, 1988,- 288 с.
18. Лепахин В. К., Белоусов Ю. Б., Моисеев В. С. Клиническая фармакология с международной номенклатурой лекарств. — М.: Изд-во Университета дружбы народов, 1988. — 445 с.
19. Липец А. И., Дозорец Ю.Л., Окороков А. И. Лечение румалоном больных первичным деформирующим остеоартрозом //Здравоохранение Белоруссии. — 1977. — № 4. — С. 66 — 68.
20. Маслаков Д. А., Эйсмонт К. А. Биологическая активность некоторых полисахаридов и их применение в клинике //Здравоохранение Белоруссии. — 1974. — № 12. — С. 35 — 38.
21. Матев М., Пехливанов Д., Томов А., Шейтанов Й. Мукартрин — терапевтичен ефект върху костно-тьканиата структура //Фармахимия. 1977. — №3.-С. 10-11.
22. Насыров X. М., Лазарева Д. Н. К механизму действия противовоспалительных средств //Физиологически активные вещества. — М.: Медицина, 1984.-С. 207-208.
23. Павленко Т. М. Применение нового органопрепарата румалона при остеоартрозе //Тер. арх. — 1969, № 12. — С. 33 — 36.
24. Панов В. П., Овсепян А. М. Физико-химическое изучение гепарина // Хим.-фарм. журн. — 1979. — № 12. — С. 72 — 86.
25. Пащук А. Ю., Мезенцева Р. М. Комплексное лечение артрозов крупных суставов с применением мукартрина и артепарона // Тр. ин-та ортопедии и травматологии. — Рига, 1971, Вып. 11. — С. 57 — 58.
26. Плиско Е. А., Нудьга Л. А., Данилов С. Н. Хитин и его химическое превращение //Успехи химии. — 1977. — Т. 46, Вып. 8. — С. 1470 — 1487.
27. Сальникова С. И., Дроговоз С. М., Зупанец И. А. Гепатозащитные свойства D-глюкозамина // Фармакология и токсикология. — 1990. — Т. 53, № 4. — С. 33 — 35.
28. СтрайерЛ. Биохимия /Пер. с англ. – M. Мир, 1984. — Т. 1. — 232 с. -1985. — Т. З.-С. 226- 229.
29. Талетене И. П., Лауцевичуе Л. З., Гуобис Г. Изучение терапевтической эффективности румалона при дистрофических заболеваниях суставов// Тр. НИИ эксперим. и клин, медицины. — Вильнюс, 1970. — Т. 12. — С. 351 — 361.
30. Триняк В. Г. Особенности развития и течения острого отека легких в условиях гипер- и гипотермии на фоне эфирного наркоза// Бюл. эксперим. биологии и медицины. — 1968, № 7. — С. 40 — 41.
31. Уайт А., Хендлер Ф., Смит Э. Основы биохимии /Пер. с англ. — М.: Мир, 1981.-Т. 1.- 534 с.
32. Хаскинсон Э. Остеоартрит (остеоартроз) /Лечение ревматических заболеваний /Пер. с англ. — Ред. Харт Ф. Д. — М.: Медицина, 1986. — С. 164- 168.
33. Чекман И. С., Пелещук А. П., Пятак О. А. Справочник по клинической фармакологии и фармакотерапии. — К.: Здоров’я, 1986. — 736 с.
34. Шитов Г. Г., Кашкарева Н. И., Городецкая В. В. //Хим.-фарм. пром- сть. Обзор, информ. — М.: ВНИИСЭНТИ Минмедпрома СССР, 1989. — Вып. 3. — 40 с.
35. Эррера А. З.Комплексное ортопедическое лечение больных ревматоидным артритом на ранних стадиях поражения коленного сустава: Ав- тореф. дис…. канд. мед. наук. — К., 1990. — 17 с.
36. Яковлева Л. В., Зупанец И. А., Дроговоз С. М., Павлий А. И. Взаимосвязь антиальтеративного и антипролиферативного эффектов индометацина, вольтарена, пироксикама и D-глюкозамина //Фармакология и токсикология. — 1988. — Т. 51, № 3. — С. 70 — 72.
37. Abatangelo G., Botti Р., Del Вие М. а\ al. Intraarticular sodium hyalu- ronate injections in the Pond-Nuki experimental model of osteoarthritis in dogs. I. Biochemical results //J. Clin. Orthopaed. — 1989. — Vol. 241. — P. 278 — 285.
38. Adam M., Crabcova V., Pesakova V. Biochemisch untersuchungen zur wirkungsurise des GAG-Peptid — Komplex rumalon//Akt Reumalol. — 1984. — P. 105- 112.
39. Adam M., Musilona J., Pesakova V. Effekt of cartilage bone marrow extract metabolism of collagen in osteoarthritic cartilage //Pharmacology. — 1980.-Vol. 21.-P.53-58.
40. Adolphe V., Blondelon D., Lechat P. Glucocorticoid Receptors in Rabbit Cultured Chondrocytes //In Vitro. — 1980. — Vol. 16, N 3. — P. 239.
41. Almasbakk K., Roysland P. Does indomethacin (1MC) prevent postoperative ectopic ossification in total hip replacement?// Acta Orthop. Scand. — 1977. — Vol. 48.-P.556.
42. Amino Sugars. The chemistry and Biology of Compounds Containing Amino Sugars. New York; London. — 1965. — Vol. 2A. — P. 1. 60 — 65.
43. Annefeld M. The Effect of Chondroprotective Substances (GAGPS) on Articutar Cartilage of the Rat //Therapiewoche. — 1984. — Vol. 34. — P. 3476 -3484.
44. Astaldi G., Strosseli E., Rinaldi C. Effect of Cartilage and Bone-marrow Extracts on Tissue Cultures in Vitro //Med. Exper. 1960, N 2. — P. 349.
45. Baici A., Jalgam P., Fehr A. Boni Inhibition of Human Lysosomal Elas- tase by the Cartilage Bone Marrow Extract Rumalon //J. Rheumatology. — Vol. 40.-P. 44
46. Bassler C., Henrotin Y„ Franchimont P. //In Vitro Assays of Chondrocyte Functions: the Influence of Drugs and Hormones //Scand. J. Rheumatology. -1990. — Suppl. 81. — P. 13-20.
47. Behrens F., Shepard N., Mitchell N. Metabolic Recovery of Articular Cartilage after Intra-articular Injections of Glucocorticoids //J. Bone Joint Surg. 1976, N 58 A. — H. 1157- 1160.
48. Biffoni M., Paroli E. Complement in vitro inhibition by a lowsulfate cho- ndroitin sulfate (matrix) //Drugs. Exper. Clin. — 1991. — Vol. 17, N 1. — P. 35 — 39.
49. Butter V. A., Sieber J. M. Prophylactic indometacin for the prevention of heterotopic bone formation folloving total hip arthroplasty //Clin. Orthop. — 1985. — Vol. 1986. — P. 217 — 224.
50. Bollet A. J.Stimulation of protein-chondroitin sulfate synthesis by normal and osteoarthritic articular cartillage //Arthritis and Rheum. — 1968. — Vol. 11,- P.663.
51. Bollet A. J., Nance J. L. Biochemical findings in normal and osteoarthritic articular cartilage. II. Chondroitin sulfate concentration and chain length, water, and ash content // J. Clin, invest. — 1966. — Vol. 45. — P. 1170 — 1177.
52. Brandt K. D., Palmoski M. J. Effect of Salicylates and Other Nonsteroidal Anti-inflammatory Drugs on Articular Cartilage // Amer. J.Med. — 1984. — Vol. 77. — Suppl. 1A. — P. 65 — 69.
53. Carter M. K., Peters L. The clearance and phosphorilatoin of glucosamine by the mammalian kidney /Arch. Internat. Pharm. Dyn. — 1958. — Vol. 113. _ p. 406- 414.
54. Chevrel В. The treatment of inflammatory diseases of the colon with salasopyndine //Med. Chir. Dig. — 1982. — Vol. 11, N 3. — P. 227 — 230.
55. Colombo C„ Butler M., Hickman L. at al., A new model of osteoarthritis in rabbits. II. Evaluation of anti-osteoarthritic effects of selected antirheumatic drugs administered systemically //Arthritis Rheum. — 1983. — Vol. 26. — P. 1132- 1139.
56. Devries В. T., Van den Berg VJ. B., van der Putte L. B. A. Salicylatein- duced Depletion of Endogenous Inorganic Sulfate. Potential Role In the Suppression of Sulfated Glycosaminoglycan Synthesis in Murine Articular Cartilage //Arthritis Rheum. — 1985. — N 28. — P. 922 — 929.
57. Dressier F. Photometric Method for the Determination of Glucosamine and Galactosamine from Glycoproteins in Blood Serum //Z. Med. Laborium Diagn. — 1985. — Vol. 26, N 6.- P. 315 — 320.
58. Eckenberger H. P. Die Therapie der Gonarthrose mit Arteparon //Rheu- mamedizin. — 1983. — N 5. — P. 32 — 40.
59. Elmstedt £., Lindholm T. S., Nilsson 0. S„ Tornkvist H. Effect of ibupro- fen on heterotopic ossification after hip replacement //Acta Orthop. Scand. — 1985.-Vol. 56(1).-P.25- 27.
60. Enislidis A. C. Gewebsverteilung von Tritium-markiertem Glycosamino- glykanpolysulfat nach intraartikular Injektion //Med. Welt. — 1972. — 23 (N. F.).
— P. 733 — 735.
61. EylauO. Die Behahdlung der Arthrosen des Knie- und Huftgelenkes mit intraartikularen Injektionen von Mukopolysaccharid polyschwefelsaureestern // Z. Orthop. — 1963. — Vol. 97. — P. 440.
62. Floman Y„ Eyre D. R., Glimecher M. J. Induction of osteoarthrosis in the rabbit knee joint: biochemical studies on the articular cartilage //Clin. Orthop, and Releated Res. — 1980,- N 147. — P. 278-286.
63. Frei P., Weigel W., Jasinski B. Experimented Untersuchungen (in Vitro) uber den Autolytischen Abbau von Kalbsknorpel //Med. Pharm. Exper. — 1967. -Vol. 16.-P. 232.
64. Garretf E. R.Properties stability, assay and puliminary pharmacokinetics of the immunomodulatory //J. Rheum. Sci. — 1972. — Vol. 71, N 4. — P. 387 — 395.
65. Gay R. £., Palmoski M. J., Brandt K. D., Gay S. Aspirin Causes in Vivo Synthesis of type Collagen by Arthrothic Articular Cartilage //Arthritis Rheum.
— 1983. — Vol. 26. — P. 1231 — 1236.
66. Gebur P., Soelberd M„ Orsnes T., Wilbek H. Naproxen prewention of heterotopic ossification after hip arthroplasty //Acta Orthop. Scand. — 1991. — Vol. 62, N 3. — P. 226 — 229.
67. Gibson T., Burry H. C„ Poswillo D., Glass J. Effect of Intraarticular Corticosteroid Injections on Primate Cartilage //Ann. Rheum. — Dis. — 1977. — Vol. 36. — P.- 74- 78.
68. Goldberg V. M„ Moskowitz R. VJ., Schwab W. Effects of Intra-articular Corticostroids and Exercise in Experimental Models of Arthritis //Proc. Twenty- second Annual Meeting Orthopaedic Res. Soc. — 1976. — Vol. 1. — P. 24.
69. Gray R. G., Gottlieb N. Z. Intraarticular Corticosteroids //Clin. Orthopaedics and Releated Research. — 1983. — N 177. — P. 235 — 264.
70. Heinegard D., Oldberg A. Structure and Biology of Cartilage and Bone Matrix Noncollagenous Macromolecules //FASEB J. — 1989. — N 9. — P. 3.
71. Hess E. V., Herman J. H. Cartilage metabolism and Anti — Inflammatory Drugs in Osteoathritis//Amer. J. of med. — 1986. — Vol. 81, Supl. 5B. — P. 36 — 43.
72. Hofman H. F. Arteparon — Basismittel in der Therapie von Arthrosen //Therapiewoche. — 1981,- Vol. 31. — P. 7133 — 7149.
73. Hofmann H. F. The chondroprotective basic treatment of osteoarthritis with glycosaminoglican polysulfate (GAGPS) //Therapiewoche. — 1985. — N
27. — P. 3223 — 3234.
75. Hollander J. L. Intrasinovial Corticosteroid Therapy in Arthritis //Md. Med. J. — 1970. — Vol. 19. — P. 62 — 64.
77. Hollander J. L. Arthrocentesis and Intrasinovial Therapy /Artritis and Allied Conditions. — Philadelphia: Lea Febiger, 1979. — P. 402 — 419.
78. Ishikawa K., Kitagawa T., Tanaka K. et al. Clinical evaluation of the intraarticular injection of glycosaminoglycan polysulfate for osteoarthrosis on the knee joint; A multicentric double-blind controlled study //Z. Orthop. — 1982,- Vol. 120.-P. 708- 716.
79. Iwangoff P., Weigel., Jasinski B. Die Bestimmung der Wasserbindungsca- pazitat von Enzymatisch Geschadigtem Knorpel und Einflus von „Rumalon” //Z. Rheumaforsch. — 1969. — Vol. 28. — P. 218.
80. Jasinski B., Morscher E. Incorporation of Sulfate S in Human Articular Cartilage. An in Vitro Study //Arthritis-Arthrose. — Bern: Hans Huber, 1971. — P. 376.
81 .KarzelK., Domenjoz R. Stimulation der Mucopolysaccharidproduction in Gewebekulturen einen Biologischen Faktor //Med. exper. — 1963. — N. 9. — P. 385.
82. KarzelK., Kolbhen D. A., Domenjoz R. Influence of a Cartilage Bonemar- row Extract („Rumalon”) on Mucopolysaccharide Metabolism of Cells Cultured in Vitro //Med. Pharm. Exper. — 1966. — Vol. 14. — H. 332.
83. Karzel K., Kalbhen D. A., Domenjoz R. Interactios between Corticosteroids and a Mucopolysaccharide containing Tissue Extract on Mucopolysaccharide Metabolism of Fibroblast Cultures //Pharmacology. — 1969. — N 2. — P. 295.
84. Koehler В. E., Urowitz M. B., Kitinger D. IV. The Systemic Effects of Intraarticular Corticosteroid //J. Rheumatol. — 1974. — N 1. — P. 117.
85. Mankin H. J., Conger K. A. The Acute Effects of Intraarticular Hydrocortisone on the Articular Cartilage in Rabbits //J. Bone Joint Surg. — 1966. — N.48 A. — P. 1383.
86. Mark K. Kollagensynthese in Chondroziten — Kulturen unter dem Einflus von Arteparon //Intern. Drag Sympossium Arteparon: EULAR Publishers Basle. — 1982,- P. 39-49.
87. Marsh J. 4-Methylumbelliferyl-alfa-N-acetylglucosaminidase Activity for Diagnosis of Sanfilippo В Disease //Clin. Genet. — 1985. — Vol. 27. N 3. — P. 258-262.
88. Mazieres В., Негаи P., Dambreville J. M., Triechart M. Die Wirkung eines Glykosaminoglycan-Peptid Komplexes (GAG-Peptid-Komplex) bei Experimen- teller Artrose am Kaninchen //Aktueile Rheumatologie. — 1984. — N 2, Bd. 9. — P. 133-138.
89. McClusky R. J„ Thomas L. The Removal of Cartilage Matrix in Vivo by Papain Prevention of Recovery with Cortisone, Hydrocortisone and Prednisolone by a Direct Action on Cartilage //Amer. J. Pathol. — 1959. — Vol. 35. — P.819.
90. McGarrachan J. F., Maley F. Hexosamine Metabolism. 1. The Metabolism in Vivo and in Vitro of D-g!ucosamin-1-C-14 and N-acetyl-D-glucosa- min-1-C-14 in Rat Liver //J. Biol. Chem. — 1962. — Vol. 237. — P. 2458-2465.
91. Mitrovic D., Me Call E., Front P. H. et al. Antiinflammatory Drags, Prostanoid and Proteoglycultured Production by Artecular Cartilage Chondrocytes //Prostaglandins. — 1984. — Vol. 28. — P. 417-434.
92. Miyakawa T. Studies on the alterations in glucosamine, galactosamine and hydroxyproline contents of the kidney, liver, serum and urin in experimental renal disease //Acta Med. Biol. — 1968. — Vol. 15. — P. 147-167.
93. Mohr IV., Kirkpatrick C. J., Wildfeuer Q„ Leitold M. Effect of Pyroxicam on Structure and Function of Joint Cartilage //Inflammation. — 1984. — N 8. — P. 139-154.
94. Moskowitz R. IV., Davis IV., Sammarco J. et al. Experimentally indused Corticosteroid Arthropathy //Arthritis Rheum. — 1970. — Vol. 13. — P. 236.
95. Newcombe D. S„ Ishikawa Y. Effect of Anti-inflammatory Agents on Human Synovial Fibroblast Prostaglandin Synthese //Prostaglandins. — 1976. — N 12.-P.849.
96. Palmoski M. J., Brandt K. D. Effect Salicylate on Proteoglycan metabolism in Normal Canine Articular Cartilage in Vitro //Arthritis Rheum. — 1979. — Vol. 22. — P. 746-754.
97. Palmoski M. J., Brandt K. D. Effect of SomeNonsteroida! Antiinflammatory Drags on Proteoglycan Metabolism and Organisation in Canine Articular Cartilage //Arthritis Rheum. — 1980. — Vol. 23. — P. 1010-1020.*
98. Palmoski M. J., Brandt K. D. Aspirin Aggravates the Degeneration of Canine Joint Cartilage Caused by Immobilisation //Arthritis Rheum. — 1982. — Vol. 25.-P. 1333-1342.
99. Palmoski M. J., Brandt K. D. Relationschip between Matrix Proteoglycan Content and the Effect of Salycylate and Indometacin on Articular Cartilage //Arthritis Rheum. — 1983. — Vol. 2Jk- P. 528-531.
100. Panse P., Meske-Brandt Muller IV. Distribution, Metabolism and Analysis of Glucosaminoglycan Polysulfate (GAGPS, Arterapon) //EULAR-Sym- posion ,’Die Artrose”. — Regensburg, T984.
101. Parrilo J. G., Fauci A. S. Mechanisms of Cortocosteroid Action on Lymphocyte Subpopulations. III. Differential Effects of Dexamethasone Administration on Subpopulations of Effector Cells Mediating Cellular Cytotoxity in
Man //Clin. Exper. Immu’», — 1978. — Vol. 31. — P. 116.
102. Pat. 2101585, G : , INT CL C07H 5/06,A 61K 31/70. Stable compound of glucosamine sulfate, a process for its preparation and pharmaceutical compositions containing this compound /Senin P., Macovec F., Rovati L. (Italy). Appl. publ. 19.01.83, N 8211996.
103. Peterson R. F., Black R. L., Bunin J. L. Disposition of Intraarticularly injected Cortisone and Hydrocortisine //Arthritis Rheum. — 1959, N 2. — P. 433.
104. Rejhotec V. Protective Effect of Rumalon on Hip Joint Cartilage in Pacient with Coxarthrosis (long-term study 1965-1980) //XV Intern. Congress of Rheumatology. — Paris, 1981.
105. Richther A. Die Wirkung von Knorpel-Knochenmarkextrakten auf die Schwebelaufnahme des Hyalinknopels //Rhoumaforsch. — 1964. — Vol. 23. — P. 405.
106. Saba T. M„ Jaffe E. Plasma Fibronectin (Opsonic Glycoprotein): Its Synthesis by Vascular Endothelial Cells and Role in Cardiopulmonary Integriti after Trauma as Related to Reticuloendotelial function //Amer. J. Med. — 1980. -Vol. 68, N 4,-P.577-594.
107. Sacks S. The Use of Hydrocortisone by Local and Intraarticular Injection in a Variety of Common Orthopaedic Conditions //Afr. Med. J. — 1955. — Vol. 29.-P.335-338.
108. Saxon A., Stevens R. H„ Ramer S. J. Glucocorticoids Administered in Vivo Inhibit Human Supression Т-Lymphocyte Function and Diminish B-Lymp- hocyte Responsiveness in Vitro Immunoglobulin Synthesis //J. Clin. Invest. — 1977.-Vol. 60. — P.922.
109. Schiovinato A., Lini G., Guidolin D. et al. Intraarticular sodium hyalu- ronate injections in the Pond-Nuki experimental model of ostheoarthritis in dogs. 11. Morphological findings //J. Clin. Orthopaed. — 1989. — Vol. 241. — P. 286-299.
110. Schmidt S. A., Кjxrsgaard-Anclersen P., Pedersen N. IV. et al. The use of indomethacin to prevent the formation of heterotopic bone after total hip replacement. A randomized, double blind clinical trial //J. Bone Joint Surg (Amer). — 1988. — Vol. 70(6). — P. 834-838.
111. Shaw /. H„ Khight C. G., Page T. D. P. et al. Liposome-incorporated Corticosteroids I. The Interaction cf Liposomal Cortisol Palmitate with Inflammatory Synovial Membrane //Br. J. Exper. Pathologia. — 1979. — Vol. 60. — P. 142.
112. Shetlar M. R., Hern D„ Bradford R. H„ Endecott B. Incorporation of (1-14-C)-Glucosamine into Serum Proteins //Biochem. and Biothys. Acta. — 1961,-Vol. 53.-P.615-616.
113. Silbermann M., Joister L„ Lewinson D. Corticosteroid-induced Mineralisation in Neonatal Condylar Cartilage //Clin. Orthop. — 1977. — Vol. 129. — P. 293-298.
114. Simmons D. P., Chrisman O. D. Salicylate inhibition of cartilage degeneration //Arthritis Rheum. — 1965. — N 8. — P. 960-969.
115. Skrivankova B., Podrazky V., Trnavsky R., Julis J. Effect of selected
antirheumatic drags on the metabolism of cartilage and synovial tissue in experimental arthropathy //Methods Find. Exper. Clin. Pharmacol. — 1991. — Vol. 13.N8.-P. 523-528.
116. Smith D. L., Kappes J., Bentley P., Benneti R. Intra-articular Therapy with Liposomal Steroids. A Comparative Study in Rabbits (Abstract) //Arthritis Rheum. — 1980,- N 6.- P. 748.
117. Soren A. Time for Salicylate Diffusion from Blood to Joint Fluid. A Study of Histopathology of the Synovial Membrane //Reumatismo. — 1977. — Vol. 29.- P. 1.
118. Strandberg B. Intraarticular Steroid Therapy: A Survey and Clinical Report //Asta Rheumatol. Scand. — 1964. — N 10. — P. 29-31.
119. Sudmann £., Dregelid E., Bessesen A., Morland J. Inhibition of Fracture Healing by Indomethacin in Rats //Eur. J. Clin. Invest. — 1979. — Vol. 9. — P. 333-339.
120. lenenbaum J., Pritzker К. P. H„ Gross A. E. et al. The Effects of Intraarticular Corticosteroids on Articular Cartilage //Semin. Artritis Rheum. — 1981. -N 11.-(Suppl. 1).- P.140.
121. Usardi M. M., Bossoni G., Tarantino P. //Pharm. Res. Commun. — 1981. -Vol. 13, N 3,-P.301-312.
122. Verbruggen G., Veys E. M. Influence of Sulfated Glycosaminoglycans upon Proteoglycan Metabolism of the Synovial Living Cells //Acta Rheum.Belg. -1977,- N1.- P.75-92.
123. Wagenhauser F. J., Jasinski B., Weigel W. The Action of „Rumalon”, an Extract of Cartilage and Bone-marrow: Experimental and Clinical Investigations //Arch. Inter. Amer. Rheum. — 1963. — N 6. — P. 463.
124. Wagenhauser F. J. Arthrose-Schicksal Oder Behandelbare Erkrankung //Akt Rheumatol. — 1984. — Sonder 2. — Bd. 9. — S. 85-152.
125. Wahlistrom 0., R/sfo 0., Djerf F., Hammerby S. Prophylactic treatment of heterotopic bone formation after hip arthroplasty //Acta Orthop. Scand. — 1989,- Vol. 60,- P. 35.
126. Weiden S. Serum Hexosamine Levels in Health and Disease //Clin. Pathol. — 1958,-Vol. 11,N 2.- P. 17-182.
127. Weigel W., Iwangoff P., Jasinski B. Die Bedentung der Katabolen Vor- gange im Knorpel und ihre Beziehungen zur Patogenese der Degenerativen Gelenkenkrancungen //Arzneimittel Forsch. — 1969. — Vol. 19. — P. 780.
128. Weigel W., Iwangoff P., Jasinski B. Der Einflus eines Knorpel-Knochen- mark-Extractes auf Rattenknorpel in Vivo /7Z. Rheumaforsch. — 1979. — Vol. 29.
— P. 348.
129. Wiger R., Stottum A., Brunford G. Estimating Chemical Developmental Hazard in a Chicken Embryo limb Fud Micromass Sistem //Pharmacology and Toxycology. — 1988. — Vol. 62, N 1. — P. 32-37.
130. Wilhelmi G. Forderme und Hemmende Einflusse von Tribenosid und acetyl salicylteure auf die Spontane Arthrose der Maus //Arzneimittelfor- schung. — 1978. — N 28. — P. 1724-1726.
131. Wilhelmi G. Effect of C21, 524-SU (pirprofen) on spontaneous osteoarthrosis in the mouse //Pharmacology. — 1978. — Vol. 16. — P. 268-272.