Синовиальные суставы — сложная многокомпонентная органоспецифическая система, включающая как элементы внутренней среды (суставные хрящи, синовиальную жидкость, синовиальную мембрану), так и прилежащую к суставному хрящу субхондральную кость, через которую в определенной мере осуществляются энергетические, пластические и механические функции суставного хряща (Павлова В. Н., 1989). Все перечисленные компоненты тесно функционально связаны и, в зависимости от характера взаимодействия и особенностей их организации, обеспечивают локомоторную функцию.
Суставные хрящи лишены сосудов, и нервов, в связи с этим характер поступления веществ и выполнение ими функций сказывается на морфологической организации. Так, эта структура характеризуется фенотипически, а по данным некоторых исследователей, и генотипически неоднородной популяцией хондроцитов, имеющих вертикальное позиционно-специфическое расположение по толще суставного хряща и специфические метаболические характеристики. Хондроциты занимают 5% объема хряща и обеспечивают биосинтез белков и углеводов, необходимых для формирования полноценного матрикса, способного выдержать механические нагрузки. В поверхностных зонах контактирующих поверхностей суставов хондроциты располагаются в 1-2 слоя, имеют овальные ядра, окруженные цитоплазмой, вытянутой в краевых отделах. Само расположение хондроцитов соответствует направлению коллагеновых волокон, образующих бесклеточную часть поверхностной зоны (Lamina splendens), то есть параллельно поверхности. Зачастую эти клетки не формируют капсул, а по электронномикроскопическим характеристикам напоминают фибробласты: они имеют ядро с компактным расположением хроматина, а их цитоплазма содержит развитый эндоплазматический ретикулум (рис. 1-1.). В этих клетках практически не определяется скоплений гликогена, являющегося одним из маркеров цитодифференцировки хондроцитов. Наиболее обширная по площади территория приходится на среднюю зону, в которой хондроциты располагаются в капсулах поодиночно или в виде изогенных групп, состоящих преимущественно из двух клеток. По электронномикроскопическим характеристикам они отличаются организацией цитоплазмы: обнаруживаются хондроциты с развитым эндоплазматическим ретикулумом, что свидетельствует о высоком уровне в них биосинтеза белков, в основном коллагена. У части клеток в цитоплазме сложно организован комплекс Гольджи и содержится большое количество секреторных гранул, что указывает на интенсификацию синтеза углеводсодержащих соединений.
Гликоген обаруживается практически во всех клетках в виде небольших диффузно расположенных по цитоплазме скоплений. Клетки глубокой зоны суставного хряща отличаются колонкообразной организацией, включающей два и более хондроцитов. В основной массе они имеют организованную цитоплазму с развитым эндоплазматическим ретикулумом, комплексом Гольджи, большим количеством митохондрий и лизосом, обширными скоплениями гликогена. Наличие последних в этих клетках трактуется как сигнал к оссификации. Если рассматривать в целом клеточную популяцию суставного хряща, то необходимо отметить, что усложнение ультраструктурной организации клеток идет по направлению от поверхностной зоны к глубокой (Brighton С. Т., Kitajimana T., Hunt R. М., 1984). В зоне кальцифицированного хряща клетки располагаются в расширенных капсулах на значительном расстоянии друг от друга, имеют плотные ядра, слабо организованную цитоплазму с большим количеством включений в виде гликогена, липидов и плотных осмиофильных частиц. Хондроциты, прилежащие к зоне оссификации, имеют пикнотичные ядра, зачастую окруженные лишь фрагментами цитоплазмы. Клетки располагаются в капсулах, размеры которых больше, чем у капсул хондроцитов других отделов хряща.
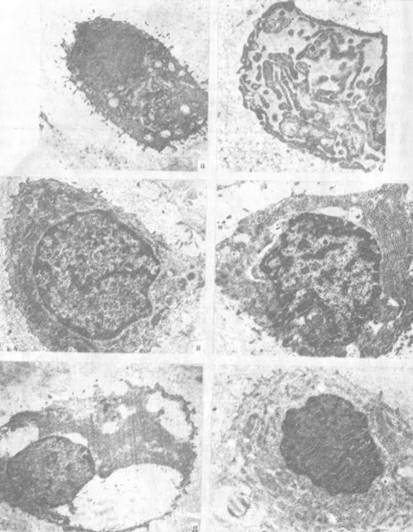
Рис. 1.1. Варианты структурной организации хондроцитов:
- хондроцит поверхностной зоны с развитыми мембранными органеллами цитоплазмы, ув. 12000;
- фрагмент хондроцита средней зоны с развитым гладким эндоплазматическим ретикулумом и скоплениями гликогена в цитоплазме, ув. 16000;
- хондроцит средней зоны с большим количеством митохондрий, ув. 12000;
- хондроцит средней зоны с развитым гранулярным эндоплазматическим ретикулумом, ув. 12000;
- хондроцит глубокой зоны, вакуолизация цитоплазмы, ув. 12000;
- хондроцит глубокой зоны, единичные канальцы эндоплазматического ретикулума, микрофиламенты и микротрубочки цитоскелета, ув. 12000; контрастировано по Рейнольдсу, ЭМВ-100БР.
В настоящее время доказана несостоятельность представления о хондроцитах как метаболически инертных клетках; получены данные, свидетельствующие о том, что этот вид клеток характеризуется высокой интенсивностью обменных процессов (Павлова В. Н. и соавт., 1988).
Хондроциты всех зон суставного хряща характеризуются определенными чертами сходства и различия по метаболическому профилю. Так, ферменты цикла Кребса, гексомонофосфатного шунта, цитохромоксидаза прогрессивно увеличиваются в цитоплазме хондроцитов, располагающихся по направлению от поверхностной к глубоким зонам хряща. Гликолитические ферменты присутствуют в хондроцитах всех зон суставного хряща, такая же ситуация характерна и для липидов (Sampson Н. W., Cannon М. S., 1986). Эти данные подтверждают ранее высказанную точку зрения о наличии двух популяций хондроцитов, в данном случае дифференцируемых по ферментам, — анаэробов и аэробов, — ориентированных в толще суставного хряща в соответствии со спецификой поступления в него питательных веществ.
С возрастом суставные хрящи претерпевают определенные изменения. В них снижается плотность хондроцитов на единицу площади. Это приводит к тому, что единичные хондроциты не могут метаболически обеспечить большие площади матрикса и катаболические процессы начинают преобладать над анаболическими. Возникающая ситуация может быть рассмотрена как „слабое звено” в системе суставного хряща. Вследствие уменьшения в клетках мембранных органелл и разрастания в них элементов цитоскелета, упрощается ультраструктурная организация хондроцитов. Однако, даже в суставных хрящах людей возрастной группы 60-80 лет, были выявлены хондроциты, по ультраструктурной организации которых можно сделать вывод об активации в них процессов биосинтеза фибриллярных битков и протеогликанов. Но в основной массе хондроциты имеют признаки инволютивной атрофии (Виноградова Е. В., Михайлов И. Н., 1983).
Хрящевые клетки являются предметом пристального внимания исследователей, так как в конечном итоге от их реактивности и пластической функции зависит биохимическая надежность матрикса.
Установлено, что дифференцировка клеток и возрастные изменения сопровождаются и характерными преобразованиями макромолекулярной организации матрикса. В целом, в хрящевых тканях, так же, как и в других видах соединительной ткани, прослеживается четкая взаимосвязь между клеточными и неклеточными компонентами. То есть клетка воспроизводит макромолекулы матрикса: коллаген, гликопротеины, протеогликаны и неколлагеновые белки, а макромолекулы, формируя микроокружения клетки, оказывают влияние на ее цитодифференцировку.
Названные компоненты находятся в матриксе в четкой взаимосвязи между собой, а в онтогенезе происходит преобразование их структурной и пространственной упорядоченности. На этих процессах остановимся более подробно.
Известно, что на этапах хондрогенеза биосинтез коллагена, одного из основных компонентов матрикса, неоднороден. С помощью биохимических и иммунологических методов исследования показано, что предхрящевые клетки синтезируют I тип коллагена (Modis L. et al., 1986). Специфической функцией хондроцитов является биосинтез коллагена II типа. Однако, даже при изучении зрелого суставного хряща, выявлено, что хондроциты поверхностной зоны могут синтезировать I тип коллагена, а в клеточном территориальном матриксе хондроцитов других зон определяются перицеллюлярные коллагены (коллаген У типа), образующие опору клеток по типу экзоцитоскелета. Кроме того, в хрящевой ткани выявлено большое количество минорных компонентов коллагена. Исследования последних лет показали, что в норме процесс обмена коллагена в хрящевой ткани длителен, при этом период полужизни макромолекул составляет от 50 до 300 дней. По теоретическим расчетам, выполненным на основе изотопных исследований, установлено, что его полный обмен в матриксе хрящей у человека может осуществляться в течение 120-360 лет (Maroudas А., 1980), то есть система матрикса имеет большой запас прочности. В целом, в матриксе хрящей коллаген составляет 50-70%, при этом большая его часть находится в составе коллагеновых волокон и именно с их ориентацией и упорядоченным расположением в толще суставного хряща связываются его прочность и функциональные свойства. В матриксе суставного хряща человека анизотропия коллагена в поверхностной и промежуточной зонах находится практически на одном уровне, а в глубокой — несколько выше. При старении, в условиях патологического процесса и физиологических сдвигов, синтез и типовой состав коллагена может изменяться. Установлено, что двойное лучепреломление коллагена во всех зонах суставного хряща остается на одном уровне до определенного возраста. Так, в поверхностной зоне — до 70 лет, в средней — до 60 лет, в глубокой — до 50 лет, а затем снижается на 27, 18 и 24% соответственно указанным выше зонам и возрастам (Дедух Н. В., 1988).
При старении увеличивается протяженность коллагеновых фибрилл и их переплетений, что вносит определенный вклад в теорию „утомляемости структуры” и способствует нарушению организации матрикса: демаскированию коллагеновых волокон, их деструкции и, соответственно, нарушению взаимосвязи с протеогликанами (Hough A. J., Weber R. J., 1986).
В связи с тем, что процесс фибриллогенеза базируется на участии в нем протеогликанов и гликопротеидов, оценке роли этих макромолекул посвящены фундаментальные исследования (Серов В. В., Шехтер А. Б., 1981, Павлова В. Н. и др., 1988). Так, показано, что протеогликаны могут присутствовать в матриксе либо в виде комплексов, либо — минорных компонентов. Важной структурной единицей протеогликановых комплексов являются гликозаминогликаны (ГАГ). На сегодняшний день выделено 8 типов ГАГ, 6 из которых — сульфатированные формы. В целом, ГАГ, присутствующие в суставном хряще могут быть объединены в три функциональные группы: 1) гиалуронаты, 2) хондроитин и хондроитинсульфаты, 3) кератансульфаты. Установлено, что для предхрящевых клеток характерен высокий уровень синтеза гиалуруновой кислоты, играющей определенную роль в пролиферации и миграции клеток. Дифференцировка клеток сопряжена с нарушением в ткани соотношения: гиалуроновая кислота/гиалуронидаза. По мере дифференцировки клеток синтез гиалуроновой кислоты снижается, а содержание гиалуронидазы и хондроитинсульфатов увеличивается. Хондроитинсульфаты распределяются довольно равномерно по толще суставного хряща, в то время как содержание кератансульфатов возрастает по направлению к глубокой зоне (Williams I. М. et al., 1988). Если сопоставить данные по содержанию в хрящах ГАГ и коллагена, то выявляется следующая картина: наиболее глубокие слои суставного хряща содержат в 2 раза больше хондроитинсульфатов и в 6 раз больше кератансульфатов по сравнению с коллагеном. С возрастанием сульфатированных форм ГАГ, отражающих более высокий уровень организации матрикса, фиксируется и повышение биосинтеза коллагена и его ориентационной упорядоченности (Foldes I. et al., 1980). На основе динамики выявления и данных по организации в матриксе этих макромолекул, исследователями постулируется точка зрения, что сульфатированные формы ГАГ являются матрицей для ориентационно упорядоченно расположенного коллагена (Серов В. В., Шехтер А. Б., 1981, Modis L. et al., 1986). В последние годы разработаны методы визуализации протеогликанов при электронной микроскопии (рис. 1.2.).
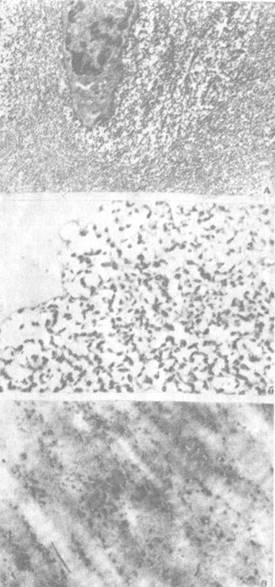
Рис. 1.2. Протеогликаны в матриксе суставного хряща (контрастировано альциановым синим 8GS.ЭMB-100БP):
- гранулы в целлюлярком и интерцеллюлярном матрикс, ув. 16000;
- варианты гранул протеогликанов, ув. 44000;
- протеогликаны и коллагеновые волокна, ув. 45000.
Известно, что в состав протеогликанового комплекса входит 5% хондроитинсульфатов, 2-7% кератансульфатов и 7-12% неколлагеновых белков (Hadley С., Phelps С., 1982; Harding- ham Т., 1981). Однако на этапах онтогенеза соотношение между этими макромолекулами не остается постоянным (Гонгадзе Н. Р., 1986; Косягин Д. В., 1983). Так, если в суставном хряще детей преобладают хондроитинсульфаты, то у взрослых — кератансульфаты (Elliott R. I., Gardner D. R., 1979; Triphaus G., Schmidt A., Buddecke E., 1980). Кроме того, с возрастом изменяется и соотношение хондроитин-4-сульфатов к хондроитин-6-сульфатам, за счет резкого снижения первого компонента и при незначительном возрастании второго TGreilind Н., 1976). Установлено изменение соотношения и плотности фракций протеогликанов с возрастом (Roughley Р. I., 1987). Кроме того, в них нарушается связь между белком и гиалуроновой кислотой (Mitrovic D. R., 1987), а также соотношение белок/гиалуроновая кислота за счет увеличения содержания первого компонента и снижения второго (Косягин Д. В., 1983). Деградация протеогликанов в суставном хряще наблюдается на протяжении всей жизни человека, но усиливается с возрастом. Это проявляется повышением фрагментации протеогликановых комплексов за счет входящих в их состав белковых цепей, гиалуроновой кислоты и гликопротеинов, которые могут в свободном виде накапливаться в тканях (Roughley Р. I., 1987). Однако протеогликаны остаются способными к агрегации с гиалуроновой кислотой, практически не изменяющей свою форму. Другие изменения протеогликанов связаны с увеличением гистидиналаниновых участков и снижением молекулярной массы протеогликанов (Hough A. J., Weber R. J., 1986).
Методами поляризационной микроскопии доказано, что в поверхностной зоне суставного хряща рефракция ГАГ сохранялась на одном уровне до 50 лет, а затем прогрессивно снижалась и достигала 34% от исходных значений. В возрастной период от 41 до 50 лет в промежуточной зоне снижение рефракции ГАГ было зафиксировано на 37%, а в группе 71 год и старше — на 50%. В глубокой зоне пик двойного лучепреломления ГАГ выявлен в возрастной группе 31-40 лет, дальнейшее снижение прослеживалось во всех остальных группах, достигая 40% к возрасту 71 год и старше (Дедух Н. В. и соавт., 1988). С возрастом в территориальном матриксе степень рефракции ГАГ уменьшалась, но всегда оставалась выше, чем в интерриториальном (рис. 1.3.). Дифференциальный анализ рефракции ГАГ показал, что старение сопровождается уменьшением анизотропии хондроитинсульфатов и увеличением во всех зонах суставного хряща рефракции кератансульфатов, достигающих в глубокой зоне возрастной группы 71 год и старше 91% от общего состава. Повышение доли кератансульфатов в суставном хряще от 60% и выше сопровождалось выраженными нарушениями степени рефракции коллагена, что проявлялось, в первую очередь, в глубокой зоне. Следует отметить, что качественные изменения фибрилл коллагена с возрастом были выявлены именно в этой зоне е помощью методов электронной микроскопии (Копьева Т. Н. и др., 1983), Описанные выше изменения структурной организации матрикса хряща приводят к нарушению ее эластических качеств.

Рис. 1.3. Гликозаминогликаны в матриксе суставного хряща:
- выраженная анизотропия, равномерное распределение в матриксе, ув. 80;
- нарушение организации. Локальная анизотропия вокруг клеток, ув. 90. Поляризованный свет. „Polmy-А”.
Еще одним важным компонентом матрикса, принимающим участие в его организации, являются макромолекулы гликопротеинов — объект пристального изучения в связи с выявлением их роли в фибриллогенезе, кальцификации тканей и некоторыми другими функциями (Шубич М. Г., Могильная Г, М, 1979; Шубич М. Г., 1980; Серов В. В., Шехтер А, Б, 1981; Хьюз Р., 1985; Anderson J., 1876). На отдельных аспектах их участия в хондрогенезе считаем необходимым остановиться. Обобщая имеющиеся данные литературы по вопросам формирования матрикса, Шубич М. Г. (1980) отмечает, что на этапах сближения и агрегации клеток у них изменяются свойства цитолеммы за счет изменения подвижности входящих в их состав гликопротеинов, что в свою очередь является стимулом для высвобождения гиалуронидазы, расщепляющей гиалуроновую кислоту на наружной поверхности мембран. При этом возрастает уровень цАМФ в клетке и в результате всех преобразований активизируются ферменты синтеза протеогликанов и коллагена. Другой важной функцией гликопротеинов является их участие в агрегации протеогликанов для обеспечения взаимосвязи их с гиалуроновой кислотой (рис. 1,4,).
Кроме того, считается, что структурные гликопротеины, как и протеогликаны, могут выступать в качестве „матрицы” для отложения коллагена и играют важную роль в организации протеогликанов и коллагеновых волокон (Robert R., Robert В, 1984; Modis L. 1974). В целом показано, что гликопротеины не только регулируют рост и ориентацию коллагеновых волокон, но и способствуют их стабилизации (Серов В. В., Шехтер А. Б.г 1981). С возрастом и в условиях патологии содержание гликопротеинов снижается, что приводит к дестабилизации коллагеновых волокон (Anderson С, Н, Salter S. 1971). У человека повышение двойного лучепреломления гликопротеинов отмечено в возрастной группе 41-50 лет, а затем наблюдалось их снижение, что было наиболее четко выражено в промежуточной и глубокой зонах суставного хряща. Именно в этой возрастной группе и начинают активно манифестировать процессы демаскирования: (фибрилляции) коллагеновых волокон.
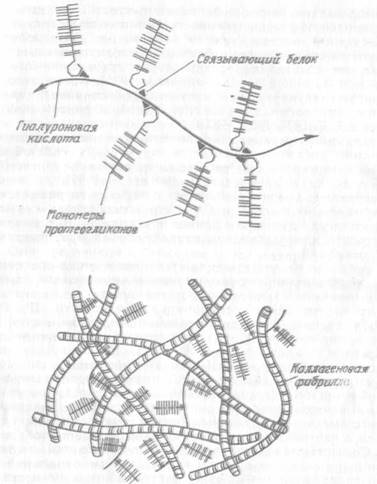
Рис. I. 4. Схема махромолекулярной организации матрикса суставного хряща.
Установлено, что в хрящевой ткани содержится особый вид гликойротеинов — хондронектин (Kevitt А. Т. et aL, 1980). Предполагается, что он является посредником для связи хондроцитов преимущественно со II типом коллагена.
Составной частью протеогликанов и гликопротеинов являются неколлагеновые белки. В протеогликановых комплексах они составляют осевую структуру (protein — core) (Romhanyi G. et al., 1975; Shipp D., Bowness J., 1975). Кроме того, они формируют структуру гликопротеинов, обеспечивающих взаимосвязь протеогликанов с гиалуроновой кислотой (link) (Нагdinghman Т. Е.,1977, 1981, 1982).
Часть неколлагеновых белков в матриксе находится в свободном состоянии. Состав и структура неколлагеновых белков изменяется с возрастом и в условиях патологии (Szirmai J. A. et al., 1967; Heinegard D., Oldberd A., 1989).
Затухание биосинтетических процессов отражается на взаимосвязи коллагена и ГАГ, что способствует снижению репаративных потенций и приводит к появлению в матриксе, в частности в коллагеновом каркасе, локальных деструктивных изменений.
В связи с тем, что трофика суставного хряща обеспечивается диффузионно-деформационным механизмом, существует выраженная зависимость суставного хряща от состава и интенсивности обмена синовиальной жидкости. Доказано, что область диффузии синовиальной жидкости в суставной хрящ составляет от 3 до 5 мм, однако на величине этого показателя сказывается ее вязкость. При этом, чем выше вязкость, тем больше смазывающая способность синовиальной жидкости, но тем меньше жидкости проникает в суставной хрящ и наоборот. Синовиальная жидкость имеет определенные черты сходства с плазмой крови, но различается присутствием и содержанием некоторых белковых компонентов, в частности соотношением альбуминов к глобулинам. (3:1). Содержание а-глобулина в синовиальной жидкости почти в три раза меньше, чем в плазме. В синовиальной жидкости содержится трансферин, гаптоглобулин, но отсутствует фибриноген, а также белки с молекулярной массой более 160000. В ней имеются ГАГ, в том числе гиалуроновая кислота, выступающая как основной компонент, связывающий воду. Кроме того, в синовиальной жидкости содержится до 30 ферментов. Ее функции многообразны. Помимо питания суставного хряща и регуляции в нем метаболических процессов, она обеспечивает смазывание суставных поверхностей, что облегчает их трение — скольжение.
Капсула суставов имеет два слоя — синовиальный и фиброзный. В образовании синовиальной жидкости принимают участие синовиоциты — клетки, выстилающие синовиальный слой капсулы. По организации синовиоциты являются специфическим клеточным компонентом покровного слоя. Это крупные клетки, содержащие большие овальные ядра, окруженные мелкодисперсной цитоплазмой. Синовиоциты относятся к полярным клеткам — ядро и органоиды в них расположены по длине оси и перпендикулярно просвету. Апикальный конец синовиоцитов часто имеет мночисленные филоподии и вакуоли (Павлова В. Н., 1980).
По ультраструктурным особенностям среди синовиоцитов можно выделить три типа клеток, условно обозначаемых как А, В и С. Клетки А — макрофагоподобные синовиоциты, содержат большое количество лизосом, они способны к активному пино- и фагоцитозу. Эти клетки наиболее многочисленны, имеют развитый комплекс Гольджи, вакуоли, митохондрии и секреторный материал, идентифицируемый как гиалуроновая кислота. В-клетки — синовиоциты фибробластического типа. Они продуцируют белковые и полисахаридные вещества. Это немногочисленная популяция клеток, имеющих развитый эндоплазматический ретикулум, преимущественно гладкого типа. С-клетки совмещают черты А и В синовиоцитов.
Остальные клеточные элементы покровного слоя — фибробласты, тучные клетки, лимфоциты и макрофаги, плазматические клетки, имеют типичное строение, свойственное клеткам соединительной ткани. Межклеточное вещество синовиального слоя богато рыхлоупакованными ретикулиновыми волокнами, агрегатами протеогликанов и гликопротеинов. Благодаря такой организации синовиальной мембраны, она выполняет функции по переносу веществ „полость сустава — кровь — полость сустава”.
Фиброзный слой капсулы представлен коллагеновыми и эластическими волокнами, обеспечивающими процессы растяжения и сжатия при перемещении суставных концов.
Суставная капсула имеет сложноорганизованное сосудистое русло, в котором капилляры подходят непосредственно к синовиоцитам покровного слоя, а также систему нервной регуляции, состоящую из многочисленных эфферентных окончаний различной структуры (пластинчатые тельца, кустиковидные свободные окончания), выступающие как проприорецепторы, рецепторы болевой чувствительности, хеморецепторы и барорецепторы. Эффекторные пути представлены симпатическими безмякотными волокнами, которые заканчиваются нервными окончаниями на гладкомышечных миоцитах сосудов и регулируют их проницаемость. С более детальным анализом организации синовиальной мембраны и синовиальной жидкости можно ознакомиться в монографии Павловой В. Н. (1980).
Возрастные изменения в капсуле по характеру принципиально не отличаются от происходящих в других тканях сустава и заключаются в уменьшении клеточности, наличии инволютивных (атрофических) изменений в клетках, увеличении объема, занимаемого в межклеточном веществе коллагеновыми волокнами. С повышением возраста в капсуле увеличивается полиморфизм коллагеновых волокон и уменьшается содержание эластических волокон.
СПИСОК ЛИТЕРАТУРЫ
- Виноградова Е. В., Михайлов И. Н. Электронногистохимическая характеристика протеогликанов гиалинового и эластического хряща человека //Структура, функция и развитие хряща в норме и патологии: Тез. докл. 3 симпоз. — М., 1983. — С. 20.
- Гонгадзе Л. Р. Мукополисахариды стареющего суставного хряща человека //Архив анат. — 1974. — Т. 67, №. 7. — С. 99-103.
- Г онгадзе Л. Р. Базофильная линия суставного хряща в норме и при некоторых патологических состояниях //Архив анат. — 1986. — Т. 79, №. 1. С. 52-57.
- Дедух Н. В. Морфологические аспекты воздействия гормонов на суставной хрящ в онтогенезе: Автореф. дис. д-ра биол. наук. — М., 1988. — 32 с.
- Дедух Н. В., Кулиш Н. И., Череватова С. X. и др. Функциональное состояние некоторых эндокринных желез у больных коксартрозом //Возрастные, адаптивные и патологические процессы в опорно-двигательном аппарате: Тез. докл. 7-ой шк. по биологии мышц. — X., 1988. — С. 191-192.
- Копьева Т. И., Мульдилров П. Я., Бельскал О. Б., Пастель В. Б. Структура суставного хряща у лиц пожилого возраста //Архив анат. — 1983. — Т. 85, № 10.-С. 60-67.
- Кослгин Д. В. Соотношение белкового и углеводного компонентов в мономерах и агрегатах протеогликанов суставного хряща человека //Структура, функция и развитие хряща в норме и патологии: Тез. докл. 3 симпоз. — М., 1983. — С. 26.
- Павлова В. Н. Синовиальная среда суставов. — М.: Медицина, 1980. С. 296.
- Павлова В. Н., Копьева Т. Н., Слуцкий Л. И., Павлов Г. Г. Хрящ. — М.: Медицина, 1988. — 320 с.
- Павлова В. Н. Компоненты внутренней среды суставов и их функциональное взаимодействие //Успехи соврем, биологии. — 1989. — Т. 107. Вып. 2. — С. 238-242.
- Серов В. 3., Шехтер А. Б. Соединительная ткань. Функциональная морфология и общая патология. — М.: Медицина, 1981. — 312 с.
- Шубич М. Г., Могильная Г. М. Гликопротеины и протеогликаны: принципы их гистохимического анализа //Архив анат. — 1979. — Т. 71, № 8. — С 92-95.
- Шубич М. Г. Механизм формирования хряща в эмбриогенезе //Природа. — 1980. — № З.-С. 26.
- Хьюз Р. Гликопротеины. — М.: Мир, 1985. — 140 с.
- Anderson I. Glycoprjteins of the connective tissue matrix //Intern. Rex Connect Tissue Res. — 1976. — Vol. 7. — P. 252-322.
- Anderson С. H., Salter S. IV. The fine structure of bovine nasal cartlage //J. Cell. Biol. — 1971. — N. 49. — P.650-663.
- Brighton С. T. The zonal analysis of cytoplasmik components of artcular cartilage //Artritis Rheum. — 1984. — Vol. 37. — P. 1290-1299.
- Greiling H. Biochemische Untersuchungen zur medikamentosen ther; pie der Arthrosen. Meniscuslasionen und posttraumatische Arthrose //Unfa heilung. — 1976. — Bd 128. — S. 87-97.
- Elliott R., Gardner D. R. Changes with agein the glycosaminoglycar of human articular cartilage //Ann. Rheum. Dis. — 1979. — Vol. 38. — 371-377.
- Foldes L., Modis L., Antalety J., Adam J. Ultrastructure of extracellul; matrix of embryonic chick limb bud and cartilage //Acta Biol. Acad. Sci. Hung. 1980. — Vol. 31. N3.-P.81-95.
- Hadley C., Phelps C. The biosynthesis in vitro of chondroitinsulfa neonatal rat epiphyseal //Biochem. — 1972. — Vol. 126. — P. 427-432.
- Hardingham T. E. Cartilage proteoglycans: structure, interactions ar organization //Med. Sci. Upsala. — 1977. — N 82. — P. 67-68.
- Hardingham T. E. The role of link-proteins in the structure of cartilat proteoglycan aggregates //Arthritis Rheum. — 1981. — Vol. 711, N 1. — P. 28-29.
- Hardingham T. E.Proteoglycans: their structure, interaction and mol cular organization in cartilage //The Sixteenth Colworth Medal Lecture. — London, 1982. — Vol. 67. — P. 489-497.
- Hevitt A. T. Identifikation of adhesive factor for chondrocytes //Prc Nat. Acad. Ski. USA. — 1980. — Vol. 77. — P. 355-388.
- Hough A. J., Weber R. J. Aging Phenomena and Osteoarthritis: cause coincidence? //Annals of clinical and laboratory science. — 1986. — Vol. 16. N. 6.-P.502-510.
- Maroudas A. Metabolism of cartilagenous tissues: a quantitative a (roach //Stud. Joint Disease. — Cambridge, 1980. — P. 59-86.
- Mitrovic D. R., Aprile F., Front Ph. Age-related changes in the structi of bovine articular cartilage proteoglicans //Joint destruction: 16-th Simposii of the European Society of Osteoartrology. — 1987. — P. 6-17.
- Modis L. Topo-optical investigations of mucopolysaccharides (ai glycosaminoglycans) //Handbuch Histochemie. Polysaccharide. Stuttgr 1984. — Vol. 11. Part 4. — P. 164.
- Modis L„ Adany R., Szekanecz Z., Raystijk G., Nagy I. Differentiation the extracellular matrix in cartilage: 21-st Symposium of the Polish Histochecal fnd Cytochemical Society. — Poland: Krakov, 1986. — P. 46.
- Robert S., Robert B. Structural glycoproteins of connective tissue, their role in morphogenetics and immunopathology //Connective Tissue, Biochemistry and Pathophysiology. — Berlin, 1974. — P. 240-256.
- Roughley P. I. Structural changes in the proteoglycans of human articular cartilage during aging //J. of Rheumatology. — 1987. — Vol. 14. — P. 14-15.
- Romhanyi G., Deak G„ Fisher G. Aldehyd-bisulfite-toluidine blue (ABT) staining as a topo-optical reaction for demonstration of linear order of vicinal OH-groups in biological structures //Histochemie. — 1975. — Vol. 43. — P. 333.
- Salter R. B., Gross A., Hamilton-Hall I. Hydrocortisone artropathy: An experimental investigation //Can. Med. Assoc. J. — 1967. — Vol. 97. — P. 374.
- Sampson H. W., Cannon M. S. Zonal analysis of metabolic profiles of articular — epiphyseal cartilage chondrocytes: a histochemical study /Histo- chemical J. — 1986. — Vol. 18. — P. 233-238.
- Shipp D., Boweness I. Insoluble noncollagenous cartilage glycoproteins with aggregation subunits //Biochem. Biophys. Acta. — 1975. — Vol. 279. — P. 282-394.
- Szirmai J. A., Tyssonak £., Gardell S. Microchemical analysis of glyco- saminoglycans, collagen, total protein and water in histological layers of nasal septum cartilage //Biochem. Biophys. Acta. — 1967. — Vol. 136, N 5. — P.331 — 340.
- Triphaus G., Schmidt A., Buddecke E. Age-related changes in the incorporation of S sulfate into two proteoglycan populations from human cartilage //Hoppe-Seylers Z. Physiol. Chem. — 1980. — Vol. 361, N 12. -P. 1773 — 1779.
- Williams l. M., Kafz R., Dchilds M. et. al. Keratan sulfate content in the superficial and deep layers of osteophytic and nonfibrillated human articular cartilage in osteoarthritis //Calcif. Tissue Int. — 1988. — Vol. 42. — P. 163- 166.